Ingin mempelajari teori Ikatan Hidrogen secara lebih mendalam? Tertarik juga untuk mengerjakan soal latihan terkait materi ini? Kamu bisa mendapatkan penjelasan materi beserta soal latihannya di sini. Yuk, langsung saja disimak!
Lewat pembahasan ini, kamu bisa belajar mengenai Ikatan Hidrogen. kamu akan diajak untuk memahami materi dan tentang metode menyelesaikan soal.
Kamu juga akan memperoleh latihan soal interaktif yang tersedia dalam tiga tingkat kesulitan, yaitu mudah, sedang, dan sukar. Tertarik untuk mempelajarinya?
Sekarang, kamu bisa mulai mempelajari materi lewat uraian berikut. Apabila materi ini berguna, bagikan ke teman-teman kamu supaya mereka juga mendapatkan manfaatnya.
Kamu dapat download modul & contoh soal serta kumpulan latihan soal ikatan hidrogen pdf pada link dibawah ini:
Definisi
Gaya tarik-menarik antara atom hidrogen yang terikat pada suatu atom yang mempunyai keelektronegatifan besar (F, O, N) dengan pasangan elektron bebas dari atom yang mempunyai keelektronegatifan besar (F, O, N).
Ikatan Hidrogen (Hydrogen Bond)
Suatu gaya antarmolekul yang relatif kuat diketahui terdapat dalam senyawa yang terbentuk dari hidrogen dengan unsur-unsur lain yang mempunyai keelektronegatifan besar, yakni F (fluorin), oksigen (O), dan nitrogen (N).
Seperti terlihat pada data titik didih senyawa-senyawa hidrida dari unsur golongan 15, 16 dan 17.

Seperti terlihat, selain $\mbox{H}_{2}\mbox{O}$, HF, $\mbox{NH}_{3}$ tren titik didih yang ditunjukkan mengikuti ketentuan yang seharusnya, dimana semakin besar massa molekul maka semakin tinggi titik didih suatu senyawa, karena semakin kuat gaya dispersinya.
Penyimpangan pada ketiga senyawa itu disebabkan oleh suatu interaksi intermolekuler lain yang disebut ikatan hidrogen. Untuk memahaminya, mari kita lihat proses pembentukan ikatan ini pada molekul air berikut.
Pada air, ikatan hidrogen-oksigen bersifat polar, dimana oksigen adalah unsur yang lebih bersifat elektronegatif sehingga akan terbentuk dipol/kutub muatan.
Ikatan ini terbentuk dengan adanya gaya elektrostatik antara atom H dari molekul air satu dengan pasangan elektron bebas pada atom O dari molekul air yang lain. Gaya intermolekul ini seakan-akan seperti lem yang menahan molekul air agar berjarak dekat satu sama lain.

Ikatan yang kuat terbentuk hanya dalam molekul yang mempunyai ikatan F-H, O-H atau N-H. Tampaknya, sepasang elektron bebas dalam sebuah atom kecil lebih efektif daripada dalam atom besar dalam hal menarik atom hidrogen.
Contoh kasus contoh ikatan hidrogen, walaupun nitrogen dan klorin mempunyai keelektronegatifan yang hampir sama, nitrogen (atom yang lebih kecil) membentuk ikatan yang jauh lebih kuat dibandingkan klorin (atom yang lebih besar). Ikatan yang teramati pada molekul $\mbox{NH}_{3}$, tetapi tidak dalam HCl.
Hydrogen Bond jauh lebih kuat daripada gaya van der Waals maupun gaya dipol-dipol. Energi untuk memutuskan ikatan ini adalah sekitar 15 sampai 40 kJ/mol, sedangkan untuk gaya van der Waals adalah sekitar 2 sampai 20 kJ/mol.
Itulah sebabnya mengapa zat yang mempunyai ikatan ini mempunyai titik cair dan titik didih yang relatif tinggi.
Contoh Soal Ikatan Hidrogen dan Pembahasannya
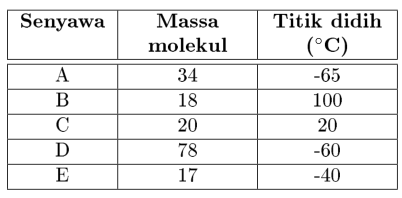
- Diketahui senyawa-senyawa berikut tentukan manakah yang mungkin memiliki ikatan hidrogen!

Jawaban
Suatu senyawa dengan massa molekul yang relatif rendah, namun memiliki titik didih yang relatif tinggi kemungkinan memiliki Hydrogen Bond. Maka, senyawa B, C dan E kemungkinan memiliki Hydrogen Bond. - Dari senyawa di bawah ini, tentukan manakah yang merupakan air, amonia dan HF! Jelaskan!

Jawaban
Diketahui bahwa B, C dan E memiliki ikatan hidrogen. Air akan memiliki titik didih paling tinggi, diikuti HF dan $\mbox{NH}_{3}$. Hal ini karena dalam setiap molekul air terdapat 2 pasang elektron bebas dan 2 atom H sehingga dapat membentuk hingga 4 hydrogen bond (optimal). Pada amonia terdapat terlalu banyak hidrogen, sementara pada HF terdapat terlalu banyak pasangan elektron bebas. - Manakah diantara etanol, asam karboksilat dan dimetil eter yang akan memiliki titik didih paling tinggi? Jelaskan!
Jawaban
Struktur molekul masing-masing
Etanol : $\mbox{C}_{2}\mbox{H}_{5}\mbox{OH}$
Asam karboksilat: $\mbox{CH}_{3}\mbox{COOH}$
Dimetil eter: $\mbox{CH}_{3}\mbox{OCH}_{3}$
Etanol dan asam karboksilat akan memiliki titik didih yang lebih tinggi di antara ketiga senyawa tersebut karena adanya ikatan O-H di dalam molekulnya memungkinkan adanya hydrogen bond. Asam karboksilat akan memiliki titik didih lebih tinggi karena polarisasi gugus -COOH yang kuat mengakibatkan hydrogen bond yang terbentuk lebih kuat.