Apa itu ikatan logam? Penasaran ingin mengetahuinya? Simak penjelasan lengkapnya di sini! Kami juga telah menyediakan soal atau kuis dengan tingkat kesulitan yang berbeda sebagai latihan.
Lewat pembahasan ini, kamu bisa belajar mengenai Ikatan Logam. kamu akan diajak untuk memahami materi dan tentang metode menyelesaikan soal.
Kamu juga akan memperoleh latihan soal interaktif yang tersedia dalam tiga tingkat kesulitan, yaitu mudah, sedang, dan sukar. Tertarik untuk mempelajarinya?
Sekarang, kamu bisa mulai mempelajari materi lewat uraian berikut. Apabila materi ini berguna, bagikan ke teman-teman kamu supaya mereka juga mendapatkan manfaatnya.
Kamu dapat download modul & contoh soal serta kumpulan latihan soal Ikatan Logam dalam bentuk pdf pada link dibawah ini:
Definisi
Ikatan yang terjadi akibat interaksi antara elektron valensi yang bebas bergerak dengan inti atau kation-kation logam yang menghasilkan gaya tarik.
Ikatan Logam (Metallic Bonding)
Dalam bentuk padat, atom-atom logam tersusun dalam susunan yang sangat rapat (closely packed). Susunan logam terdiri atas ion-ion logam dalam lautan atau awan elektron (sea of electron).
Hal ini dimungkinkan karena sifat logam yang mudah melepaskan elektron, delokalisasi juga diperkuat oleh inti logam yang menjadi bermuatan positif setelah melepas elektron valensinya. Metallic bonding dapat digambarkan sebagai berikut:
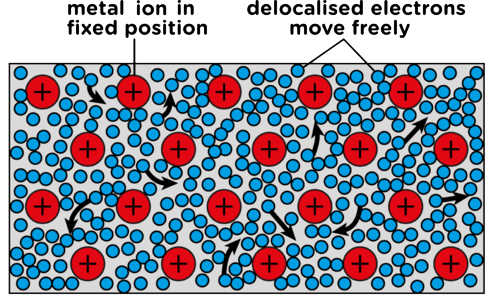
Ikatan logam inilah yang berperan membentuk sifat-sifat logam, antara lain:
- Pada suhu kamar umumnya padat (titik leleh dan titik didih sangat tinggi)
- Mengkilap
- Dapat ditempa dan dibentuk
Sifat logam yang mudah ditempa terjadi karena lautan elektron pada kristal logam dapat memegang erat inti atom logam dengan fleksibel, sehingga ketika ada benturan/tempaan metallic bonding tidak terputus melainkan hanya bergeser seperti digambarkan berikut:

Faktor-faktor yang mempengaruhi kekuatan ikatan logam dan contohnya adalah sbb;
- Jumlah elektron valensi: semakin banyak elektron yang dapat dilepaskan oleh suatu logam maka semakin tinggi densitas awan/lautan elektron dan semakin kuat lah metallic bonding-nya
Contoh: Logam Mg mempunyai elektron valensi dibandingkan logam natrium, sehingga logam Mg lebih kuat dibanding logam Na. - Muatan ion logam / kation: semakin besar muatan kation, semakin besar kekuatan logamnya, sehingga tarikan ion logam/kation dengan elektron terdelokalisasi semakin kuat dan semakin kuat metallic bonding-nya.
Contoh ikatan logam: logam Mg mempunyai muatan +2 $(\mbox{Mg}^{2+})$, sedangkan logam Na mempunyai muatan +1 $\mbox{(Na}^{+})$. Sehingga Mg lebih kuat daripada Na. - Ukuran ion logam (kation): Semakin kecil ukuran kation, semakin besar kekuatan logamnya, sehingga tarikan ion logam/kation dengan elektron terdelokalisasi semakin kuat dan semakin kuat ikatan logamnya.
Contoh ikatan logam: Kation $\mbox{Mg}^{2+}$pada logam Mg mempunyai ukuran lebih kecil dibandingkan ukuran ion $\mbox{Ba}^{2+},$ pada logam Ba. Sehingga logam Mg lebih kuat dibandingkan logam Ba.
Contoh Soal Ikatan Logam dan Pembahasannya
- Logam diketahui adalah suatu penghantar panas atau lsitrik yang baik. Meski demikian hal ini hanya berlaku pada wujudnya dalam fase padat dan lelehan, tidak pada larutan maupun gas. Jelaskan!
Jawaban
Suatu logam dapat menghantarkan listrik dan panas melalui perantaraan lautan/awan elektron di dalam ikatan antar atomnya. Ikatan ini hanya terdapat pada fase padatan dan cairan, pada fase gas dan larutan sudah tidak terdapat ikatan logam. - Tentukan manakah diantara logam berikut yang akan memiliki titik leleh lebih tinggi!
- Na, Al atau Mg
- Ba, Ca, atau Mg
Jawaban
Semakin kuat metallic bonding maka semakin tinggilah titik leleh dan titik didihnya. Maka kita lihat kembali faktor apa yang mempengaruhi kekuatan ikatan logam.
- Faktor pertama adalah jumlah elektron valensi, semakin banyak maka semakin kuat metallic bonding. Sehingga disini Al akan memiliki titik leleh yang paling tinggi karena ia memiliki 3 elektron valensi, Na hanya 1 sementara Mg ada 2 elektron valensi. Jadi urutan kekuatan ikatan logamnya adalah Al > Mg > Na.
- Kekuatan logam Mg > Ca > Ba. Karena ukuran kation $\mbox{Mg}^{2+}<\mbox{Ca}^{2+}<\mbox{Ba}^{2+}$, sehingga tarikan ion logam/kation dengan elektron terdelokalisasi semakin kuat dan semakin kuat ikatan logamnya.


