Kalau kamu ingin mempelajari pembahasan tentang Teori Orbital Molekul, simak penjelasan lengkapnya di sini. Setelah mempelajari materinya, kamu bisa mengerjakan soal-soal latihan yang telah disediakan.
Lewat pembahasan ini, kamu bisa belajar mengenai Teori Orbital Molekul. kamu akan diajak untuk memahami materi dan tentang metode menyelesaikan soal.
Kamu juga akan memperoleh latihan soal interaktif yang tersedia dalam tiga tingkat kesulitan, yaitu mudah, sedang, dan sukar. Tertarik untuk mempelajarinya?
Sekarang, kamu bisa mulai mempelajari materi lewat uraian berikut. Apabila materi ini berguna, bagikan ke teman-teman kamu supaya mereka juga mendapatkan manfaatnya.
Kamu dapat download modul & contoh soal serta kumpulan latihan soal teori orbital molekul pdf pada link dibawah ini:
Definisi
Pengertian teori orbital molekul (molecular orbital theory) adalah merupakan teori yang menjelaskan bagaimana tumpang tindih dan penggabungan orbital atom pada molekul.
Teori Orbital Molekul
Dalam molecular orbital terdapat 2 orbital yang dengan nama orbital bonding dan anti-bonding. Orbital molekul bonding adalah orbital dengan rapatan elektron ikatan terpusat mendekat pada daerah antara kedua inti atom yang bergabung dan akan lebih stabil.
Pengertian orbital molekul anti-bonding adalah orbital rapatan elektron ikatan terpusat yang menjauh dari daerah antara inti atom yang bergabung dan bersifat kurang stabil.
1. Diagram orbital molekul $\mbox{H}_{2}$

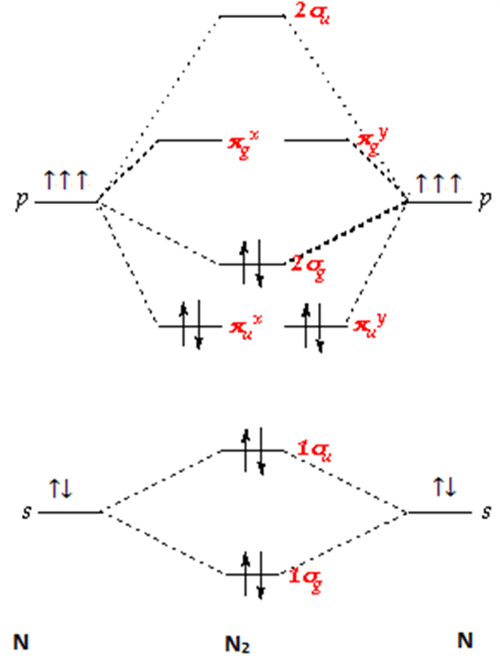
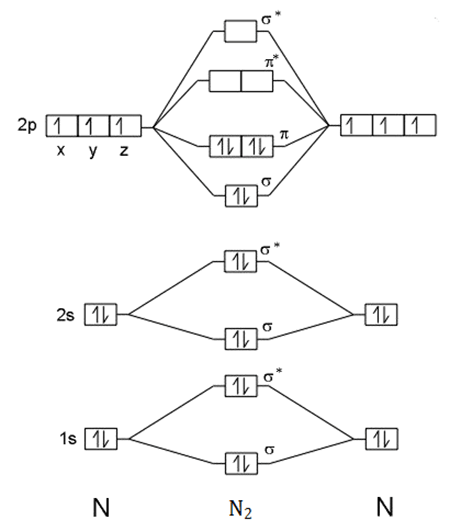
2. Diagram orbital molekul $\mbox{N}_{2}$ dan $\mbox{O}_{2}$


3. Orde Ikatan
Dalam molecular orbital theory, kestabilan ikatan kovalen berhubungan dengan orde ikatan. Jika nilai orde ikatan lebih besar dari 0, berarti molekul tersebut stabil sedangkan jika nilai orde ikatan sama dengan 0, maka molekul tersebut tidak stabil.
Orde ikatan sebanding dengan ukuran stabilitas termal.$\mbox{orde ikatan}=\frac{\sum elektron\, ikatan-\sum elektron\, anti\, ikatan}{2}$
Contoh menentukan orde ikatan pada $\mbox{O}_{2}$
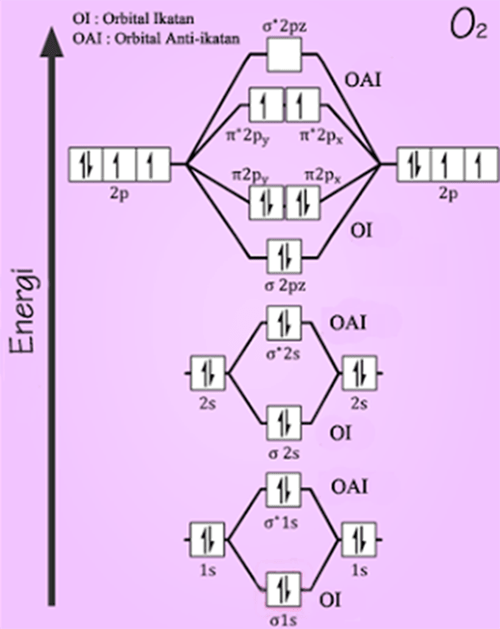
$\begin{alignedat}{1}\mbox{orde ikatan }\mbox{O}_{2} & =\frac{10-6}{2}\\
& =2
\end{alignedat}
$
Contoh Soal dan Pembahasan
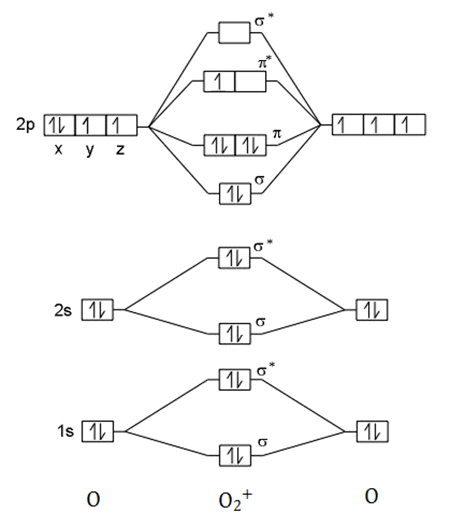
Terdapat spesi $\mbox{N}_{2}$ dan $\mbox{O}_{2}^{+}$
- Manakah yang lebih stabil antara $\mbox{N}_{2}$ atau $\mbox{O}_{2}^{+}$ ? Jelaskan!
- Manakah yang merupakan spesi paramagnetik?
- Tuliskan konfigurasi elektron ion $\mbox{O}_{2}^{+}$ tersebut dalam konteks orbital molekul (molecular orbital)!
Jawaban
-
- menggambarkan orbital molekul $\mbox{N}_{2}$
$_{7}\mbox{N}:1s^{2}2s^{2}2p^{3}$

menggambarkan molecular orbital $\mbox{O}_{2}^{+}$
$_{8}\mbox{O}:1s^{2}2s^{2}2p^{4}$

Kestabilan dapat dilihat dari nilai orde ikatannya,
Orde ikatan $\mbox{N}_{2}=\frac{10-6}{2}=2$Orde ikatan $\mbox{O}_{2}^{+}=\frac{10-5}{2}=2,5$
Karena orde ikatan $\mbox{O}_{2}^{+}>\mbox{N}_{2}$, maka $\mbox{O}_{2}^{+}$ lebih stabil. - Sifat paramagnetik dikarenakan adanya elektron yang tidak berpasangan. Dari diagram molecular orbital, dapat dilihat bahwa $\mbox{O}_{2}^{+}$ mempunyai elektron tidak berpasangan sedangkan pada $\mbox{N}_{2}$, semua elektronnya berpasangan semua. Sehingga $\mbox{O}_{2}^{+}$ yang mempunyai sifat paramaagnetik.
- konfigurasi elektron ion $\mbox{O}_{2}^{+}$: $(\sigma_{1s})^{2}(\sigma_{1s}^{*})^{2}(\sigma_{2s})^{2}(\sigma_{2s}^{*})^{2}(\sigma_{2pz})^{2}(\pi_{2p})^{4}(\pi_{2p}^{*})^{1}$
- menggambarkan orbital molekul $\mbox{N}_{2}$
Latihan Soal Teori Orbital Molekul (Mudah)
Ringkasan kuis
0 dari 5 pertanyaan telah diselesaikan
Pertanyaan:
- 1
- 2
- 3
- 4
- 5
Informasi
You have already completed the quiz before. Hence you can not start it again.
Quiz is loading...
Anda harus masuk atau mendaftar untuk memulai kuis.
Anda harus menyelesaikan kuis dibawah ini, untuk memulai kuis ini:
Hasil
Hasil
0 dari 5 pertanyaan terjawab dengan benar
Waktu yang telah berlalu
Kategori
- Tidak Berkategori 0%
- 1
- 2
- 3
- 4
- 5
- Terjawab
- Tinjau
-
Pertanyaan ke 1 dari 5
1. Pertanyaan
Manakah pernyataan di bawah ini yang tepat tentang prinsip pembentukan orbital molekul?
BetulKombinasi orbital atom menghasilkan 2 \textbf{jenis }orbital molekul (OM) (bisa berjumlah lebih dari 2 tergantung atom yang bergabung).
Kombinasi konstruktif-> energi OM lebih rendah -> orbital ikatan.
Kombinasi destruktif -> energi OM lebih tinggi -> orbital anti-ikatan.
Orbital anti-ikatan dilambangkan dengan $\sigma^{*}$ atau $\pi^{*}$.
Elektron mengisi orbital ikatan terlebih dulu.SalahKombinasi orbital atom menghasilkan 2 \textbf{jenis }orbital molekul (OM) (bisa berjumlah lebih dari 2 tergantung atom yang bergabung).
Kombinasi konstruktif-> energi OM lebih rendah -> orbital ikatan.
Kombinasi destruktif -> energi OM lebih tinggi -> orbital anti-ikatan.
Orbital anti-ikatan dilambangkan dengan $\sigma^{*}$ atau $\pi^{*}$.
Elektron mengisi orbital ikatan terlebih dulu. -
Pertanyaan ke 2 dari 5
2. Pertanyaan
Sesuai teori orbital molekul maka molekul $\mbox{H}_{2}$ akan bersifat …
BetulOrbital molekul untuk hidrogen dapat digambarkan sebagai berikut:

Karena semua elektron di dalam orbital molekul berpasangan maka molekul ini bersifat diamagnetik. Sifat $\mbox{H}_{2}$ sebagai gas pada suhu ruang tidak berhubungan dengan orbital molekulnya.
SalahOrbital molekul untuk hidrogen dapat digambarkan sebagai berikut:

Karena semua elektron di dalam orbital molekul berpasangan maka molekul ini bersifat diamagnetik. Sifat $\mbox{H}_{2}$ sebagai gas pada suhu ruang tidak berhubungan dengan orbital molekulnya.
-
Pertanyaan ke 3 dari 5
3. Pertanyaan
Manakah diantara pernyataan berikut yang paling tepat mengenai molekul $\mbox{H}\mbox{e}_{2}$?
BetulOrbital molekul untuk $He_{2}$:

$\mbox{Orde}\mbox{ikatan}=\frac{\Sigma\mbox{elektron pada orbital ikatan}-\Sigma\mbox{ elektron pada orbital anti-ikatan}}{2}$.
Untuk $\mbox{H}\mbox{e}_{2}$ didapat bahwa orde ikatannya 0, yang dapat diartikan bahwa secara rata-rata terbentuk 0 ikatan diantara atomnya, sehingga molekul ini bersifat tidak stabil.
SalahOrbital molekul untuk $He_{2}$:

$\mbox{Orde}\mbox{ikatan}=\frac{\Sigma\mbox{elektron pada orbital ikatan}-\Sigma\mbox{ elektron pada orbital anti-ikatan}}{2}$.
Untuk $\mbox{H}\mbox{e}_{2}$ didapat bahwa orde ikatannya 0, yang dapat diartikan bahwa secara rata-rata terbentuk 0 ikatan diantara atomnya, sehingga molekul ini bersifat tidak stabil.
-
Pertanyaan ke 4 dari 5
4. Pertanyaan
Dengan menggunakan prinsip teori orbital molekul, manakah pernyataan yang tepat mengenai ion $\mbox{H}_{2}^{-}$?
BetulOrbital molekul untuk $\mbox{H}_{2}^{-}$:

Dengan orde ikatan: 1/2, ion ini termasuk stabil. Bersifat paramagnetik karena adanya elektron tak berpasangan.
SalahOrbital molekul untuk $\mbox{H}_{2}^{-}$:

Dengan orde ikatan: 1/2, ion ini termasuk stabil. Bersifat paramagnetik karena adanya elektron tak berpasangan.
-
Pertanyaan ke 5 dari 5
5. Pertanyaan
Manakah pernyataan yang tepat mengenai molekul diatomik untuk dua unsur periode kedua, Li dan Be?
BetulOrbital molekul untuk $\mbox{L}\mbox{i}_{2}$:

Orde ikatan $\mbox{L}\mbox{i}_{2}=1$.
Untuk $\mbox{B}\mbox{e}_{2}$ , yang memiliki orbital valensi $2s^{2}$, maka pada orbital anti-ikatannya juga terisi sepasang elektron, sehingga orde ikatannya adalah 0 dan bersifat tidak stabil.
SalahOrbital molekul untuk $\mbox{L}\mbox{i}_{2}$:

Orde ikatan $\mbox{L}\mbox{i}_{2}=1$.
Untuk $\mbox{B}\mbox{e}_{2}$ , yang memiliki orbital valensi $2s^{2}$, maka pada orbital anti-ikatannya juga terisi sepasang elektron, sehingga orde ikatannya adalah 0 dan bersifat tidak stabil.
Latihan Soal Teori Orbital Molekul (Sedang)
Ringkasan kuis
0 dari 5 pertanyaan telah diselesaikan
Pertanyaan:
- 1
- 2
- 3
- 4
- 5
Informasi
You have already completed the quiz before. Hence you can not start it again.
Quiz is loading...
Anda harus masuk atau mendaftar untuk memulai kuis.
Anda harus menyelesaikan kuis dibawah ini, untuk memulai kuis ini:
Hasil
Hasil
0 dari 5 pertanyaan terjawab dengan benar
Waktu yang telah berlalu
Kategori
- Tidak Berkategori 0%
- 1
- 2
- 3
- 4
- 5
- Terjawab
- Tinjau
-
Pertanyaan ke 1 dari 5
1. Pertanyaan
Apabila ion $\mbox{H}_{2}^{-}$ tereksitasi oleh cahaya, maka …
BetulOrbital molekul untuk ion $\mbox{H}_{2}^{-}$:

Eksitasi akibat cahaya menyebabkan perpindahan 1 elektron dari orbital dengan energi lebih rendah $\sigma_{1s}$ ke $\sigma_{2s}^{*}$. Sehingga orde ikatan menjadi: -1/2, sehingga bersifat tidak stabil.
Sifat kemagnetannya meski demikian tetap sama, yakni paramagnetik karena adanya elektron yang tidak berpasangan.
SalahOrbital molekul untuk ion $\mbox{H}_{2}^{-}$:

Eksitasi akibat cahaya menyebabkan perpindahan 1 elektron dari orbital dengan energi lebih rendah $\sigma_{1s}$ ke $\sigma_{2s}^{*}$. Sehingga orde ikatan menjadi: -1/2, sehingga bersifat tidak stabil.
Sifat kemagnetannya meski demikian tetap sama, yakni paramagnetik karena adanya elektron yang tidak berpasangan.
-
Pertanyaan ke 2 dari 5
2. Pertanyaan
Bila dua orbital 2p saling mendekat untuk mendekat, berapa jumlah total orbital molekul yang akan terbentuk?
BetulKetika 2 orbital 2p saling mendekat untuk membentuk ikatan akan terbentuk total 6 ortbital molekul karena terbentuknya 2 jenis ikatan, yakni ikatan $\sigma$ dan ikatan $\pi$. Terbentuk 1 orbital ikatan sigma dan 1 anti-ikatannya, serta 2 orbital ikatan pi dan 2 orbital anti-ikatannya seperti diagram berikut ini:
 Salah
SalahKetika 2 orbital 2p saling mendekat untuk membentuk ikatan akan terbentuk total 6 ortbital molekul karena terbentuknya 2 jenis ikatan, yakni ikatan $\sigma$ dan ikatan $\pi$. Terbentuk 1 orbital ikatan sigma dan 1 anti-ikatannya, serta 2 orbital ikatan pi dan 2 orbital anti-ikatannya seperti diagram berikut ini:

-
Pertanyaan ke 3 dari 5
3. Pertanyaan
Berikut ini manakah yang memiliki ikatan paling panjang?
BetulUntuk orbital molekul yang terbentuk dari 2 unsur yang sama, semakin tinggi orde ikatan maka semakin pendek ikatan yang terbentuk.
-Untuk gas oksigen, orbital molekul yang terbentuk dari kedua orbital $2p^{4}$
orde ikatan: $\frac{1}{2}\times(6-2)=2$
-Untuk $\mbox{O}_{2}^{+}$:
orde ikatan: $\frac{1}{2}\times(6-1)=2,5$
-Untuk anion peroksida ($\mbox{O}_{2}^{2-}$):
orde ikatan: $\frac{1}{2}\times(6-4)=1$
-Untuk anion superoksida ($\mbox{O}_{2}^{-}$):
orde ikatan: $\frac{1}{2}\times(6-3)=1,5$
Maka, ion dengan panjang ikatan paling besar adalah $\mbox{O}_{2}^{2-}$ yang memiliki orde ikatan paling kecil.SalahUntuk orbital molekul yang terbentuk dari 2 unsur yang sama, semakin tinggi orde ikatan maka semakin pendek ikatan yang terbentuk.
-Untuk gas oksigen, orbital molekul yang terbentuk dari kedua orbital $2p^{4}$
orde ikatan: $\frac{1}{2}\times(6-2)=2$
-Untuk $\mbox{O}_{2}^{+}$:
orde ikatan: $\frac{1}{2}\times(6-1)=2,5$
-Untuk anion peroksida ($\mbox{O}_{2}^{2-}$):
orde ikatan: $\frac{1}{2}\times(6-4)=1$
-Untuk anion superoksida ($\mbox{O}_{2}^{-}$):
orde ikatan: $\frac{1}{2}\times(6-3)=1,5$
Maka, ion dengan panjang ikatan paling besar adalah $\mbox{O}_{2}^{2-}$ yang memiliki orde ikatan paling kecil. -
Pertanyaan ke 4 dari 5
4. Pertanyaan
Diantara ion-ion berikut manakah yang bersifat diamagnetis?
- $\mbox{N}_{2}^{2-}$
- $\mbox{O}_{2}^{2-}$
- $\mbox{B}\mbox{e}_{2}^{2+}$
- $\mbox{C}_{2}^{-}$
BetulOrbital molekul $\mbox{N}_{2}^{2-}$:

ParamagnetisOrbital molekul $O_{2}^{2-}$:

DiamagnetisOrbital molekul $Be_{2}^{2+}$

DiamagnetisOrbital molekul $C_{2}^{-}$

ParamagnetisSalahOrbital molekul $\mbox{N}_{2}^{2-}$:

ParamagnetisOrbital molekul $O_{2}^{2-}$:

DiamagnetisOrbital molekul $Be_{2}^{2+}$

DiamagnetisOrbital molekul $C_{2}^{-}$

Paramagnetis -
Pertanyaan ke 5 dari 5
5. Pertanyaan
Diantara ion berikut, berapakah yang orde ikatannya akan bertambah bila menangkap 1 elektron?
- $\mbox{B}_{2}^{+}$
- $\mbox{L}\mbox{i}_{2}^{+}$
- $\mbox{N}_{2}^{+}$
- $\mbox{N}\mbox{e}_{2}^{2+}$
BetulOrbital molekul masing-masing:

Orde ikatan akan bertambah bila elektron yang ditangkap masuk ke dalam orbital ikatan, dan sebaliknya bila elektron masuk ke dalam orbital anti-ikatan orde ikatan menjadi berkurang, sehingga pada $\mbox{B}_{2}^{+}$, $\mbox{L}\mbox{i}_{2}^{+}$, $\mbox{N}_{2}^{+}$bertambah sementara $\mbox{N}\mbox{e}_{2}^{2+}$ berkurang.
SalahOrbital molekul masing-masing:

Orde ikatan akan bertambah bila elektron yang ditangkap masuk ke dalam orbital ikatan, dan sebaliknya bila elektron masuk ke dalam orbital anti-ikatan orde ikatan menjadi berkurang, sehingga pada $\mbox{B}_{2}^{+}$, $\mbox{L}\mbox{i}_{2}^{+}$, $\mbox{N}_{2}^{+}$bertambah sementara $\mbox{N}\mbox{e}_{2}^{2+}$ berkurang.
Latihan Soal Teori Orbital Molekul (Sukar)
Ringkasan kuis
0 dari 5 pertanyaan telah diselesaikan
Pertanyaan:
- 1
- 2
- 3
- 4
- 5
Informasi
You have already completed the quiz before. Hence you can not start it again.
Quiz is loading...
Anda harus masuk atau mendaftar untuk memulai kuis.
Anda harus menyelesaikan kuis dibawah ini, untuk memulai kuis ini:
Hasil
Hasil
0 dari 5 pertanyaan terjawab dengan benar
Waktu yang telah berlalu
Kategori
- Tidak Berkategori 0%
- 1
- 2
- 3
- 4
- 5
- Terjawab
- Tinjau
-
Pertanyaan ke 1 dari 5
1. Pertanyaan
Diantara ion-ion berikut berapakah jumlah ion yang bersifat diamagnetis?
- $\mbox{C}\mbox{O}^{+}$
- $\mbox{N}\mbox{O}^{-}$
- $\mbox{O}\mbox{F}^{+}$
- $\mbox{Ne}\mbox{F}^{+}$
BetulOrbital molekul $\mbox{C}\mbox{O}^{+}$, terdapat $2p^{2}$ dari C dan $2p^{4}$ dari O, kemudian dikurangi 1 elektron, total 5 elektron pada orbital molekul 2p

Paramagnetis
Pada $\mbox{N}\mbox{O}^{-}$ terdapat $2p^{3}$ dari N dan $2p^{4}$dari O, ditambah 1 elektron, total 8 elektron pada orbital molekul 2p:

Paramagnetis
Pada $\mbox{O}\mbox{F}^{+}$ terdapat $2p^{4}$ dari O dan $2p^{5}$ dari F, dikurangi 1 elektron, total 8 elektron pada orbital molekul 2p

Paramagnetis
Pada $\mbox{Ne}\mbox{F}^{+}$, terdapat $2p^{6}$ dari Ne dan $2p^{5}$ dari F, dikurangi 1 elektron, total 10 elektron pada orbital molekul 2p

Diamagnetis
SalahOrbital molekul $\mbox{C}\mbox{O}^{+}$, terdapat $2p^{2}$ dari C dan $2p^{4}$ dari O, kemudian dikurangi 1 elektron, total 5 elektron pada orbital molekul 2p

Paramagnetis
Pada $\mbox{N}\mbox{O}^{-}$ terdapat $2p^{3}$ dari N dan $2p^{4}$dari O, ditambah 1 elektron, total 8 elektron pada orbital molekul 2p:

Paramagnetis
Pada $\mbox{O}\mbox{F}^{+}$ terdapat $2p^{4}$ dari O dan $2p^{5}$ dari F, dikurangi 1 elektron, total 8 elektron pada orbital molekul 2p

Paramagnetis
Pada $\mbox{Ne}\mbox{F}^{+}$, terdapat $2p^{6}$ dari Ne dan $2p^{5}$ dari F, dikurangi 1 elektron, total 10 elektron pada orbital molekul 2p

Diamagnetis
-
Pertanyaan ke 2 dari 5
2. Pertanyaan
Berapa jumlah elektron non-ikatan pada HF?
BetulOrbital molekul untuk HF terbentuk dari $1s^{1}$ milik H dan $2p^{5}$ milik F, ikatan yang terbentuk adalah ikatan $\sigma$ dengan diagram sebagai berikut:

Terdapat 6 elektron non ikatan.
SalahOrbital molekul untuk HF terbentuk dari $1s^{1}$ milik H dan $2p^{5}$ milik F, ikatan yang terbentuk adalah ikatan $\sigma$ dengan diagram sebagai berikut:

Terdapat 6 elektron non ikatan.
-
Pertanyaan ke 3 dari 5
3. Pertanyaan
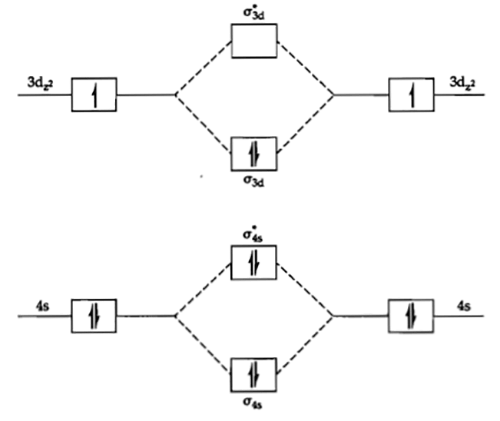
Manakah yang merupakan HOMO dari $\mbox{S}\mbox{c}_{2}$?
BetulDengan elektron terluar pada $4s^{2}$$3d^{1}$, maka orbital molekul yang terbentuk adalah

HOMO (\emph{Highest Occupied Molecular Orbital}) adalah orbital berenergi tertinggi yang berisi elektron. Pada $\mbox{S}\mbox{c}_{2}$ adalah $\sigma3d$.
SalahDengan elektron terluar pada $4s^{2}$$3d^{1}$, maka orbital molekul yang terbentuk adalah

HOMO (\emph{Highest Occupied Molecular Orbital}) adalah orbital berenergi tertinggi yang berisi elektron. Pada $\mbox{S}\mbox{c}_{2}$ adalah $\sigma3d$.
-
Pertanyaan ke 4 dari 5
4. Pertanyaan
Sesuai dengan teori orbital molekul, manakah diantara benzena, naftalena dan antrasena yang paling mungkin memiliki warna?
BetulStrukturnya masing-masing:

Senyawa yang berwarna adalah senyawa yang memiliki gap energi HOMO-LUMO paling rendah, artinya ia juga akan menyerap foton dengan energi rendah. Senyawa yang tidak berwarna biasanya akan menyerap foton berenergi tinggi (memantulkan foton dengan energi rendah, panjang gelombang besar pada radiasi \emph{visible} yang terlihat mata).
Semakin banyak ikatan rangkap terkonjugasi maka semakin kecil gap energi HOMO-LUMO, sehingga yang paling mungkin memiliki warna adalah tetrasena.
SalahStrukturnya masing-masing:

Senyawa yang berwarna adalah senyawa yang memiliki gap energi HOMO-LUMO paling rendah, artinya ia juga akan menyerap foton dengan energi rendah. Senyawa yang tidak berwarna biasanya akan menyerap foton berenergi tinggi (memantulkan foton dengan energi rendah, panjang gelombang besar pada radiasi \emph{visible} yang terlihat mata).
Semakin banyak ikatan rangkap terkonjugasi maka semakin kecil gap energi HOMO-LUMO, sehingga yang paling mungkin memiliki warna adalah tetrasena.
-
Pertanyaan ke 5 dari 5
5. Pertanyaan
Pada orbital molekul air, yang merupakan LUMO adalah …
BetulOrbital molekul untuk air ($\mbox{H}_{2}\mbox{O}$):
 Salah
SalahOrbital molekul untuk air ($\mbox{H}_{2}\mbox{O}$):