Masih sering bingung dengan Teori VSEPR? Yuk, simak penjelasan lengkapnya lewat uraian berikut. Setelahnya, kamu juga bisa mengerjakan latihan soal yang telah disediakan untuk mengasah kemampuan belajarmu.
Lewat pembahasan ini, kamu bisa belajar mengenai Teori VSEPR. kamu akan diajak untuk memahami materi dan tentang metode menyelesaikan soal.
Kamu juga akan memperoleh latihan soal interaktif yang tersedia dalam tiga tingkat kesulitan, yaitu mudah, sedang, dan sukar. Tertarik untuk mempelajarinya?
Sekarang, kamu bisa mulai mempelajari materi lewat uraian berikut. Apabila materi ini berguna, bagikan ke teman-teman kamu supaya mereka juga mendapatkan manfaatnya.
Kamu dapat download modul & contoh soal serta kumpulan latihan soal teori vsepr pdf pada link dibawah ini:
Definisi
Pengertian geometri molekul adalah susunan ruang atom-atom dalam molekul.
Pengertian hibridisasi adalah suatu konsep bersatunya orbital-orbital atom membentuk orbital hibrid yang baru dalam pembentukan ikatan. Konsep ini berfungsi menjelaskan terjadinya bentuk/geometri molekul.
Teori VSEPR (Valence Shell Electron Pair Repulsion)
Dalam penentuan bentuk atau geometri molekul, perlu diperhitungkan keberadaan elektron tak-berikatan dan elektron valensi ketika pembentukan ikatan. Teori ini disebut juga teori domain elektron, suatu pengembangan dari teori VSEPR (Valence Shell Electron Pair Repulsion).
Pada teori ini terdapat dua jenis domain, yaitu domain elektron bebas untuk pasangan elektron bebas dan domain elektron ikatan untuk elektron dalam ikatan, dimana satu pasang elektron bebas dianggap satu domain elektron.
Satu ikatan baik itu tunggal, rangkap dua maupun tiga juga dianggap satu domain elektron. Dari jumlah total domain inilah didapatkan bentuk-bentuk dasar untuk berbagai molekul seperti berikut:
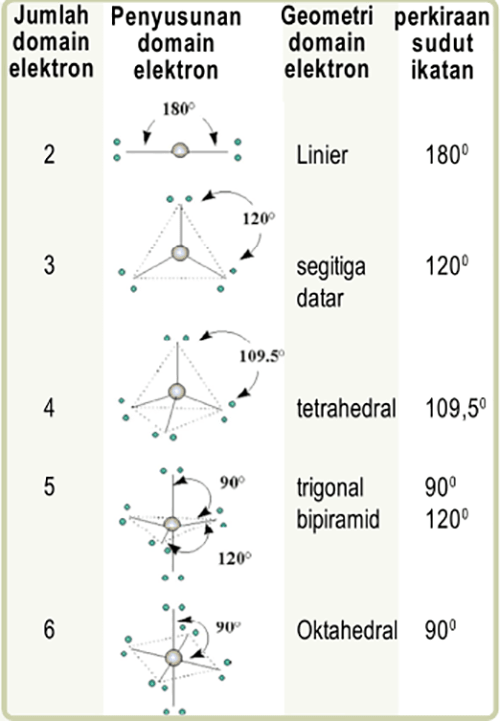
A. Prinsip-prinsip dasar dari teori domain elektron
Selain itu prinsip-prinsip dasar dari teori domain elektron adalah sebagai berikut
- Antardomain elektron pada kulit luar atom pusat saling tolak-menolak, sehingga domain elektron akan mengatur diri sedemikian rupa untuk meminimalisir gaya tolak-menolak ini.
- Pasangan elektron bebas (PEB) mempunyai gaya tolak yang sedikit lebih kuat daripada pasangan elektron ikatan.
Hal itu terjadi karena pasangan elektron bebas hanya terikat pada satu atom, sehingga gerakannya lebih leluasa. Urutan kekuatan tolak-menolak diantara pasangan elektron adalah sebagai berikut.
Tolakan antar PEB > tolakan antara PEB dan pasangan elektron ikatan > tolakan antar pasangan elektron ikatan
B. Menentukan geometri molekul
Untuk menentukan geometri molekul ikuti langkah-langkah berikut ini:
- Menentukan tipe molekul.
Atom pusat dilambangkan dengan A, elektron ikatan dengan X dan setiap domain elektron bebas dinyatakan dengan E. Caranya berbeda tergantung jenis molekul/senyawanya.- Senyawa biner berikatan tunggal, maka setiap ikatan hanya menggunakan satu elektron dari atom pusat. Maka, jumlah PEB (E) dapat ditentukan:
$E=\frac{(EV-X)}{2}$
Dimana EV = jumlah elektron valensi atom pusat X = jumlah atom yang terikat pada atom pusat - Senyawa biner berikatan rangkap atau kovalen koordinat
$E=\frac{EV-X’}{2}$
Dimana X’ : jumlah elektron yang digunakan atom pusat
- Senyawa biner berikatan tunggal, maka setiap ikatan hanya menggunakan satu elektron dari atom pusat. Maka, jumlah PEB (E) dapat ditentukan:
- Menentukan geometri domain-domain elektron di sekitar atom pusat yang memberi tolakan minimum
- Menetapkan domain elektron terikat dengan menuliskan lambang atom yang bersangkutan
- Menentukan geometri molekul setelah mempertimbangkan pengaruh pasangan elektron bebas
Bentuk molekul
Sehingga bila dirangkum, berikut bentuk molekul dengan adanya PEB :
Untuk jumlah domain 2 hingga 4
Berikut bentuk molekul dengan adanya PEB untuk jumlah domain 2 hingga 4

Untuk jumlah domain 5 dan 6 :
Berikut bentuk molekul dengan adanya PEB untuk jumlah domain 5 hingga 6

Teori Hibridisasi
Menurut teori hibridisasi, ikatan terjadi akibat terbentuknya orbital hibrida, yakni orbital yang terbentuk sebagai hasil penggabungan 2 atau lebih orbital atom.
Sebagai contoh lihat penggabungan orbital s dan p pada karbon di dalam metana ($\mbox{CH}_{4}$) berikut:
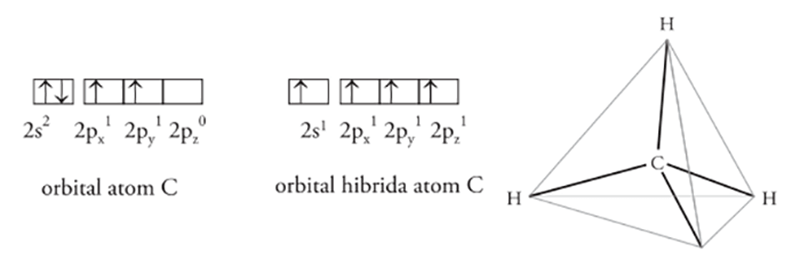
Atom C pada kulit valensinya memiliki 3 orbital, yaitu $2s^{2}$, $2p_{x}^{1}$, $2p_{y}^{1}$, dan sebuah orbital kosong, $2p_{z}^{0}$.
Keempat orbital ini dapat berhibridisasi membentuk empat orbital $sp^{3}$. Masing-masing orbital hibrid dari atom C inilah yang digunakan untuk berikatan dengan 4 orbital s dari 4 atom H membentuk sebuah molekul $\mbox{CH}_{4}$ dengan bentuk molekul tetrahedral.
Hubungan antara jenis hibridisasi atom pusat dengan bentuk molekul
Bila dirangkum, maka berikut ini hubungan antara jenis hibridisasi atom pusat dengan bentuk molekul

Contoh Soal Teori VSEPR dan Pembahasannya
- Tentukan tipe molekul untuk senyawa berikut!
a. $\mbox{SF}_{4}$
b. $\mbox{BF}_{3}$
Jawaban
Kedua molekul ini memiliki ikatan tunggal, sehingga- $\mbox{SF}_{4}$
Jumlah elektron valensi atom pusat (S) : 6
Jumlah domain elektron ikatan (X) = 4
Jumlah domain elektron bebas (E) :
$\begin{aligned}\frac{(6-4)}{2} & =1\end{aligned}$ - $\mbox{BF}_{3}$
Dengan cara yang sama didapat tipe molekul $AX_{3}$
- $\mbox{SF}_{4}$
- Tentukan tipe molekul untuk senyawa berikut!
a. $\mbox{XeO}_{4}$
b. $\mbox{POCl}_{3}$
Jawaban- $\mbox{XeO}_{4}$
Ikatan antara atom xenon dengan atom oksigen dalam molekul ini adalah ikatan rangkap dua.
Jumlah elektron valensi atom pusat = 8
Jumlah domain elektron ikatan (X) =4, tetapi jumlah elektron yang digunakan atom pusat =$4\times2=8$
Sehingga, PEB :$\frac{8-8}{2}=0$Sehingga tipe molekulnya $AX_{4}$ - $\mbox{POCl}_{3}$
Ikatan antara P dan O adalah ikatan rangkap dua sementara dengan Cl adalah ikatan tunggal, sehingga jumlah elektron yang digunakan atom pusat totalnya adalah 5. Maka PEB:
$\frac{5-5}{2}=0$
Sehingga tipe molekulnya $AX_{4}$
- $\mbox{XeO}_{4}$
- Tentukan geometri molekul yang tepat untuk senyawa di bawah ini
a. $\mbox{Cl}_{2}\mbox{O}$
b. $\mbox{SCl}_{4}$
c. $\mbox{XeF}_{2}$
Jawaban- $\mbox{Cl}_{2}\mbox{O}$ memiliki tipe $AX_{2}E_{2}$
Jumlah domain : $2+2=4$
bentuk dasar tetrahedral, bentuk molekul yang paling tepat adalah tekuk/bengkok/bentuk V - $\mbox{SCl}_{4}$ memiliki tipe $AX_{4}E$,
Jumlah domain : $4+1=5$
bentuk dasar trigonal bipiramidal, bentuk molekul yang paling tepat adalah jungkat-jungkit/tetrahedral terdistorsi - $\mbox{XeF}_{2}$ memiliki tipe $AX_{2}E_{3}$
Jumlah domain : $2+3=5$
bentuk dasar trigonal bipirmaidal, bentuk molekul yang paling tepat adalah bentuk T, dimana PEB diletakkan pada posisi ekuatorial untuk mengurangi tolakan.
- $\mbox{Cl}_{2}\mbox{O}$ memiliki tipe $AX_{2}E_{2}$
- Tentukan hibridisasi atom pusat untuk molekul di bawah ini
a. $\mbox{BCl}_{3}$
b. $\mbox{SCl}_{6}$
c. $\mbox{CH}_{2}$
d. $\mbox{Br}_{2}$
e. $\mbox{NH}_{4}^{+}$
Jawaban:
Tentukan notasi molekul tersebut, kemudian jumlah domainnya, maka didapatkan jenis hibridisasinya- notasi: $AB_{3}$, jumlah domain 3, maka hibridisasi $sp^{2}$

- notasi $AB_{6}$, jumlah domain 6 maka hibridisasi $sp^{3}d^{2}$
- notasi $AB_{3}E$, jumlah domain 4, maka hibridisasi $sp^{3}$
- notasi $A_{2}$, linier, hibridisasi sp
- notasi $AB_{4}$, jumlah domain 4, maka hibridisasi $sp^{3}$
- notasi: $AB_{3}$, jumlah domain 3, maka hibridisasi $sp^{2}$








