Kalau kebetulan kamu ingin belajar lebih tentang Kapasitas Kalor dan Sistem Fasa, kamu bisa menyimak pembahasannya berikut. Setelahnya, kamu bisa mengerjakan kuis berupa latihan soal untuk mengasah kemampuan belajarmu.
Lewat pembahasan ini, kamu bisa belajar mengenai Kapasitas Kalor dan Sistem Fasa. Kamu akan diajak untuk memahami materi dan tentang metode menyelesaikan soal.
Kamu juga akan memperoleh latihan soal interaktif yang tersedia dalam tiga tingkat kesulitan, yaitu mudah, sedang, dan sukar. Tertarik untuk mempelajarinya?
Sekarang, kamu bisa mulai mempelajari materi lewat uraian berikut. Apabila materi ini berguna, bagikan ke teman-teman kamu supaya mereka juga mendapatkan manfaatnya.
Kamu dapat download modul & contoh soal serta kumpulan latihan soal Kapasitas Kalor dan Sistem Fasa dalam bentuk pdf pada link dibawah ini:
Definisi
Kalor adalah salah satu bentuk energi yang dapat diterima/dilepas oleh suatu materi.
Fasa adalah sejumlah zat yang homogen baik secara kimia maupun fisika. Secara umum telah dikenal tiga kelompok, yaitu fasa gas, fasa cair dan fasa padat.
Kapasitas Kalor
Kapasitas kalor (C) didefinisikan sebagai banyaknya kalor yang diperlukan untuk menaikkan suhu suatu zat sebanyak 1 ºC atau 1 K.
$\mbox{C}=\frac{\mbox{Q}}{\Delta\mbox{T}}$
Pada gas, perubahan suhu dapat dilakukan dengan proses isobarik (tekanan tetap) atau proses isokhorik (volume tetap). Dengan demikian, kapasitas kalor gas dapat dibedakan menjadi dua, yakni kapasitas kalor pada tekanan tetap ($\mbox{C}_{p}$) dan kapasitas kalor pada volume tetap ($\mbox{C}_{v}$).
Perumusan kedua pada kapasitas kalor tersebut secara matematis dapat dituliskan sebagai berikut. Kapasitas kalor pada volume tetap ($\mbox{C}_{v}$), adalah
$\mbox{C}_{v}=\frac{Q_{v}}{\Delta T}$ , $\mbox{C}_{p}=\frac{Q_{p}}{\Delta T}$
Jika besaran $Q_{v}$dan $Q_{p}$ dimasukkan ke dalam persamaan Hukum Pertama Termodinamika, akan didapatkan persamaan berikut.
1. Pada proses isokhorik
$Q_{v}=\Delta U+W$, karena volume sistem tetap, maka usaha sistem (W = 0), sehingga $Q_{v}=\Delta U$ (persamaan 1)
2. Pada proses isobarik
$Q_{p}=\Delta U+W$, karena tekanan sistem tetap, maka usaha sistem ($\mbox{W}=p\Delta V$), sehingga $Q_{p}=\Delta U+p\Delta V$ (persamaan 2)
dengan mensubstitusikan persamaan 1 dan 2, diperoleh
$Q_{p}-Q_{v}=p\Delta V$ (persamaan 3)
Selanjutnya, jika persamaan kapasitas kalor ke dalam persamaan 3, akan diperoleh
$(C_{p}\Delta T)-(C_{v}\Delta T)=p\Delta V$ (persamaan 4)
$C_{p}-C_{v}=\frac{p\Delta V}{\Delta T}$, Berdasarkan persamaan gas ideal pV = nRT persamaan 4, akan menjadi $C_{p}-C_{v}=nR$
untuk gas monoatomik $C_{v}=\frac{3}{2}R$
untuk gas diatomik $C_{v}=\frac{5}{2}R$
Sistem Fasa
A. Sistem 1 komponen
Pada tahun 1876, Gibbs menurunkan hubungan sederhana antara jumlah fasa setimbang, jumlah komponen, dan jumlah besaran intensif bebas yang dapat melukiskan keadaan sistem secara lengkap. Menurut Gibbs
$F=C-P+\gamma$
F = derajat kebebasan
C = jumlah komponen
P = jumlah fasa
γ = jumlah besaran intensif yang mempengaruhi sistem (P, T)
Derajat kebebasan suatu sistem adalah bilangan terkecil yang menunjukkan jumlah variabel bebas (suhu, tekanan, konsentrasi komponen-komponen) yang harus diketahui untuk menggambarkan keadaan sistem. Untuk zat murni, diperlukan hanya dua variabel untuk menyatakan keadaan, yaitu P dan T, atau P dan V, atau T dan V.
Variabel ketiga dapat ditentukan dengan menggunakan persamaan gas ideal. Sehingga, sistem yang terdiri dari satu gas atau cairan ideal mempunyai derajat kebebasan dua (F = 2).
Kondisi fasa – fasa dalam sistem satu komponen digambarkan dalam diagram fasa yang merupakan plot kurva tekanan terhadap suhu.

Titik A pada kurva menunjukkan adanya kesetimbangan antara fasa-fasa padat, cair, dan gas. Titik ini disebut sebagai titik triple . Untuk menyatakan keadaan titik triple hanya dibutuhkan satu variabel saja yaitu suhu atau tekanan. Sehingga derajat kebebasan untuk titik triple adalah nol. Sistem demikian disebut sebagai sistem invarian .
1. Persamaan Clapeyron
Bila dua fasa dalam sistem satu komponen berada dalam kesetimbangan, kedua fasa tersebut mempunyai energi Gibbs molar yang sama. Pada sistem yang memiliki fasa α dan β,
$G_{\alpha}=G_{\beta}$
Jika tekanan dan suhu diubah dengan tetap menjaga kesetimbangan, maka
$\delta G_{\alpha}=\delta G_{\beta}$
$\left(\frac{\delta G_{\alpha}}{\delta P}\right)_{T}dP+\left(\frac{\delta G_{\alpha}}{\delta P}\right)_{P}dT=\left(\frac{\delta G_{\beta}}{\delta P}\right)_{T}dP+\left(\frac{\delta G_{\beta}}{\delta P}\right)_{P}dT$
Dengan menggunakan hubungan Maxwell, didapat
$V_{\alpha}dP-S_{\alpha}dT=V_{\beta}dP-S_{\beta}dT$
$\frac{dP}{dT}=\frac{S_{\beta}-S_{\alpha}}{V_{\beta}-V_{\alpha}}=\frac{\Delta S}{\Delta V}$
karena, $\Delta S=\frac{\Delta H}{T}$, maka $\frac{dP}{dT}=\frac{\Delta H}{T\Delta V}$ (persamaan Clapeyron)
Persamaan tersebut dapat digunakan untuk menentukan entalpi penguapan, sublimasi, dan peleburan. Entalpi sublimasi, peleburan, dan penguapan pada suhu tertntu dihubungkan dengan persamaan
$\Delta H_{sublimasi}=\Delta H_{peleburan}+\Delta H_{penguapan}$
2. Persamaan Clausius-Clapeyron
Untuk peristiwa penguapan dan sublimasi, Clausius menunjukkan bahwa persamaan Clapeyron dapat disederhanakan dengan mengandaikan uapnya mengikuti hukum gas ideal dan mengabaikan volume cairan ($V_{l}$) yang jauh lebih kecil dari volume uap ($V_{g}$)
$\Delta V=V_{g}-V_{l}\approx V_{g}$, Jika $V_{g}=\frac{RT}{P}$, maka persamaan Clapeyron berubah menjadi
$\frac{dP}{dT}=\frac{P\Delta H}{RT^{2}}$
$\frac{dP}{P}=\frac{\Delta H}{RT^{2}}dT$
$_{P_{1}}^{P_{2}}\int\frac{1}{P}dP=\frac{\Delta H}{R}_{T_{1}}^{T_{2}}\int\frac{1}{T^{2}}dT$
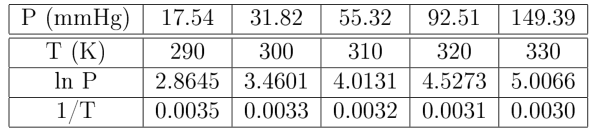
ln $\frac{P_{2}}{P_{1}}=\frac{\Delta H}{R}\left[-\frac{1}{T_{2}}-\left(-\frac{1}{T_{1}}\right)\right]$
ln$\frac{P_{2}}{P_{1}}=\frac{\Delta H(T_{2}-T_{1})}{RT_{1}T_{2}}$ (persamaan Clausius-Clapeyron)
Dengan menggunakan persamaan di atas, kalor penguapan atau sublimasi dapat dihitung dengan dua tekanan pada dua suhu yang berbeda. Bila entalpi penguapan suatu cairan tidak diketahui, harga pendekatannya dapat diperkirakan dengan menggunakan Aturan Trouton , yaitu
$\Delta S_{penguapan}=\frac{\Delta H_{penguapan}}{T_{didih}}\cong88J/Kmol$
B. Sistem 2 komponen
Sistem dua komponen dapat berupa campuran fasa cair-cair, cair-padat, cair-gas, atau fasa padat-padat. Karakteristik setiap campuran memiliki ciri yang khas. Ada yang membentuk campuran homogen atau satu fasa pada P,T dan berbagai komposisi dan ada juga campuran yang membentuk heterogen pada P,T dan berbagai komposisi.
Diagram fasa untuk sistem dua komponen digambarkan sebagai fungsi komposisi terhadap tekanan atau komposisi terhadap suhu. Oleh sebab itu aturan derajat kebebasan (F) menjadi = 2 – P (karena salah satu variabel (P atau T) dalam keadaan konstan).
1. Sistem 2 komponen cair-gas ideal
Jika campuran dua cairan nyata ($real$) berada dalam kesetimbangan dengan uapnya pada suhu tetap, potensial kimia dari masing-masing komponen adalah sama dalam fasa gas dan cairnya.
$\mu_{i}(l)=\mu_{i}(g)$………………….(i)
Jika uap dianggap gas ideal, maka
$\mu_{i}(g)=\mu\text{º}_{i}(g)+RT$ ln $\frac{P_{i}}{P^{0}}$ ($P^{0}$adalah tekanan standar 1 bar),
untuk fasa cair berlaku,
$\mu_{i}(l)=\mu\text{º}_{i}(l)+RT$ ln $a_{i}$
persamaan (i) dapat ditulis menjadi
$\mu\text{º}_{i}(l)+RT$ ln $a_{i}$=$\mu\text{º}_{i}(g)+RT$ ln $\frac{P_{i}}{P^{0}}$
RT ln $a_{i}$= RT ln $\frac{P_{i}}{P^{0}}$
$a_{i}=\frac{P_{i}}{P^{0}}$………………………(ii)
persamaan (ii) menyatakan bahwa jika uap merupakan gas ideal, maka aktifitas dari komponen i pada larutan adalah perbandingan tekanan parsial zat i di atas larutan ($P_{i}$) dan tekanan uap murni dari zat i ($P_{i}$ ).
Pada tahun 1884, Raoult mengemukakan hubungan sederhana yang dapat digunakan untuk memperkirakan tekanan parsial zat i di atas larutan ($P_{i}$) dari suatu komponen dalam larutan. Menurut Raoult tekanan uap larutan ideal dipengaruhi oleh tekanan uap pelarut dan fraksi mol zat terlarut yang terkandung dalam larutan tersebut
$P_{i}=X_{i}.P^{0}$ (Hukum Raoult)
Hukum ini akan dipenuhi bila komponen-komponen dalam larutan mempunyai sifat yang mirip atau interaksi antar larutan besarnya sama dengan interaksi di dalam larutan. Campuran ideal memiliki sifat-sifat $\Delta H_{mix}=0,\Delta V=0,$ dan
$\Delta S_{mix}=-R\Sigma n_{i}$ln i. Contohnya adalah campuran benzena dan toluena.
Tekanan uap total di atas campuran adalah
$P=P_{1}+P_{2}=x_{1}P_{1}^{0}+x_{2}P_{2}^{0}$, karena $x_{2}=1-x_{1}$
$P=P_{2}^{0}+(P_{1}^{0}-P_{2}^{0})x_{1}$
Persamaan di atas digunakan untuk membuat garis titik gelembung ($bubble$$point$$line$). Di atas garis ini, sistem berada dalam fasa cair. Komposisi uap pada kesetimbangan ditentukan dengan cara
$x_{i}=\frac{P_{i}}{P}$
Keadaan campuran ideal yang terdiri dari dua komponen dapat digambarkan dengan kurva tekanan tehadap fraksi mol berikut

Jika suatu sistem udara kontak dengan cairan air diperkirakan pada kesetimbangan, selanjutnya udara dijenuhkan dengan air. Fraksi mol uap air dalam udara biasanya ditemukan dari hukum Raoult yang diterapkan ke air dengan asumsi bahwa tidak ada udara yang terlarut dalam fasa cair. Oleh karena itu, cairan air dianggap murni ($x_{2}=1)$.
Namun, jika dihitung fraksi mol udara yang terlarut dalam air maka hukum Raoult tidak dapat diterapkan, karena temperatur kritis udara lebih rendah dari $25\text{ºC}$.
Permasalahan ini dapat diselesaikan dengan hukum Henry, diterapkan untuk tekanan cukup rendah yang fasa uapnya dapat diasumsikan sebagai gas ideal.
$P_{i}=x_{i}.K_{i}$ (Hukum Henry)
Nilai K adalah tetapan Henry yang besarnya tertentu untuk setiap pasangan pelarut-zat terlarut.
Tetatapn Henry untuk gas-gas terlarut pada suhu$25 ºC$($10^{-9}\mbox{Pa})$

Contoh Soal Kapasitas Kalor dan Sistem Fasa Beserta Pembahasannya
1. Tekanan parsial $CO_{2}$di udara adalah $3.5\times10^{-8}atm.$ Hitung kelarutan $CO_{2}$ dalam air pada suhu $25 ºC$.
Jawaban
$P_{CO_{2}}=x_{CO_{2}}.K_{CO_{2}}$
$x_{CO_{2}}=\frac{P_{CO_{2}}}{K_{CO_{2}}}=\frac{3.5\times10^{-8}}{1.65\times10^{-3}}atm$ = $2.12\times10^{-5}$
$x_{CO_{2}}=\frac{n_{CO_{2}}}{n_{total}}$dengan $n_{total}\cong n_{H_{2}O},$ $x_{CO_{2}}=\frac{n_{CO_{2}}}{n_{H_{2}O}}$
$n_{H_{2}O}=\frac{massa_{H_{2}O}}{Mr_{H_{2}O}}=\frac{1000g}{18g/mol}=55.56$mol
$n_{CO_{2}}=x_{CO_{2}}\times n_{H_{2}O}$=$2.12\times10^{-5}\times55.56$ = $1.18\times10^{-3}$mol
maka, kelaarutan $CO_{2}$dalam air adalah $\frac{1.18\times10^{-3}mol}{1L}=1.18\times10^{-3}M$