Kalau kamu ingin belajar sifat periodik unsur secara lebih mendalam, coba simak penjelasan yang ada di sini. Setelah menerima materi, kamu bisa langsung mempraktikkannya dengan mengerjakan latihan soal yang telah kami sediakan.
Lewat pembahasan ini, kamu bisa belajar mengenai Sifat Periodik Unsur. kamu akan diajak untuk memahami materi dan tentang metode menyelesaikan soal.
Kamu juga akan memperoleh latihan soal interaktif yang tersedia dalam tiga tingkat kesulitan, yaitu mudah, sedang, dan sukar. Tertarik untuk mempelajarinya?
Sekarang, kamu bisa mulai mempelajari materi lewat uraian berikut. Apabila materi ini berguna, bagikan ke teman-teman kamu supaya mereka juga mendapatkan manfaatnya.
Kamu dapat download modul & contoh soal serta kumpulan latihan soal Sifat Periodik Unsur dalam bentuk pdf pada link dibawah ini:
Definisi
Sifat-sifat yang ada hubungannya dengan letak unsur dalam sistem periodik, yang berulang dan berubah sesuai dengan perubahan nomor atom dan konfigurasi elektron.
Sifat Sifat Periodik Unsur
Sifat sifat unsur yang berulang secara periodik disebut pula sifat periodik unsur, yang meliputi:
1. Jari-jari atom dan ion
Jari-jari atom dan ion adalah jarak dari inti atom dengan orbital elektron terluar yang stabil. Jari-jari atom dalam satu golongan dari atas ke bawah cenderung semakin besar karena jumlah kulit yang bertambah.
Sementara untuk unsur-unsur dalam satu periode, dari kiri ke kanan jari-jari atom cenderung semakin kecil karena muatan inti efektif yang semakin besar (ditandai dengan jumlah proton yang bertambah sementara jumlah kulit tetap sehingga tarikan inti dengan elektron kulit terluar semakin besar. Berikut ini jari-jari atom beberapa unsur.
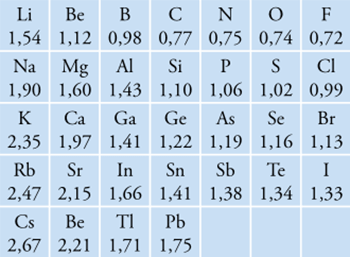
Suatu atom yang melepas elektron terluarnya akan membentuk ion positif, mengakibatkan ukurannya menjadi lebih kecil. Sebaliknya bila atom tersebut menangkap elektron pada kulit terluarnya ia akan membentuk ion negatif dan memiliki ukuran yang lebih besar.
2. Energi ionisasi
Pengertian energi ionisasi adalah energi yang dibutuhkan oleh atom atau ion dalam keadaan gas untuk melepaskan satu buah elektron pada kulit terluarnya. Grafik energi ionisasi untuk unsur-unsur dapat dilihat sebagai berikut:

Tampak bahwa dalam satu periode, dari kiri ke kanan energi ionisasi (EI) cenderung meningkat diakibatkan semakin kuatnya muatan inti efektif menyebabkan elektron terluar semakin sulit dilepas.
Sementara itu dalam 1 golongan dari atas ke bawah EI cenderung menurun akibat jarak elektron terluar ke inti atom yang semakin menjauh.
3. Afinitas Elektron
Pengertian afinitas elektron adalah perubahan energi yang menyertai suatu atom atau ion dalam keadaan gas menerima satu elektron.
Dalam satu periode dari kiri ke kanan harga afinitas elektron (AE) cenderung semakin negatif, yang menandakan dilepaskan energi yang lebih besar, artinya lebih mudah untuk menerima elektron diakibatkan semakin tingginya muatan inti efektif.
Sementara dalam satu golongan dari atas ke bawah cenderung semakin positif karena inti atom yang semakin jauh dari orbital terluar menyulitkannya untuk menarik elektron. Nilai AE beberapa unsur dapat dilihat dalam tabel berikut ini:

4. Elektronegativitas
Pengertian elektronegativitas adalah kecenderungan suatu atom untuk menarik pasangan elektron dalam suatu ikatan, yang dinyatakan dalam skala Pauling, dengan harga elektronegativitas terbesar adalah 4,0 (atom F) , dan terendah adalah 0,7 (Fr). Nilai elektronegativitas unsur-unsur dapat dilihat berikut ini:

Secara umum periodisitasnya sama dengan AE< dalam satu periode dari kiri ke kanan cenderung meningkat, dalam satu golongan dari atas ke bawah cenderung menurun.
5. Sifat Sifat Logam dan Non Logam
Sifat sifat logam Dalam satu periode dari kiri ke kanan sifat logam (kecenderungan melepas elektron terluar) semakin menurun akibat semakin meningkatnya energi ionisasi. Sebaliknya sifat non logam dari kiri ke kanan akan meningkat.
Dalam satu golongan, dari atas ke bawah sifat logam cenderung meningkat karena semakin besarnya ukurna atom memudahkan untuk elektron terluar untuk lepas dari atom tersebut. Sebaliknya sifat non-logam dari atas ke bawah cenderung menurun.
Materi Sifat Periodik Unsur Tingkat Olimpiade
1. Bilangan Oksidasi Tertinggi
Untuk unsur-unsur yang dapat memiliki lebih dari satu tingkat oksidasi, tingkat/bilangan oksidasi tertingginya adalah sesuai dengan jumlah elektron di kulit valensinya.
Sebagai contoh berikut ini tingkat/bilangan oksidasi tertinggi yang dapat dimiliki logam transisi periode keempat, sesuai dengan total elektron di orbital s dan d terluarnya:
- Scandium $4s^{2}3d^{1}$ : +3
- Titanium $4s^{2}3d^{2}$ : +4
- Vanadium $4s^{2}3d^{3}$: +5
- Kromium $4s^{1}3d^{5}$: +6
- Mangan $4s^{2}3d^{5}$: +7
Penyimpangan mulai terjadi dari triade besi (Fe, Co, Ni) serta Cu dan Zn. Hal ini diakibatkan peningkatan energi ionisasi elektron orbital d yang drastis serta jumlah elektron d yang banyak secara energetika tidak disukai dalam pembentukan ikatan, sehingga untuk logam transisi yang disebutkan tadi lebih umum kita temukan pada tingkat oksidasi yang rendah dalam senyawanya.
Ringkasan bilangan/tingkat oksidasi yang mungkin serta tingkat oksidasi yang umum (warna merah) dapat dilihat pada diagram berikut

Bilangan oksidasi tertinggi logam transisi yang pernah terobservasi adalah +8, ditemui pada unsur Os/Osmium dalam senyawa $OsO_{4}$.
2. Kecenderungan Sifat Fisik Golongan Utama
(a) Golongan I:
- Titik leleh dan titik didih dari atas ke bawah cenderung menurun karena kekuatan ikatan logamnya menurun (akibat ukuran atom logam yang semakin besar melemahkan interaksi inti atom dengan lautan elektron)
- Densitas/massa jenis cenderung meningkat akibat dalam satu golongan dari atas ke bawah massanya akan meningkat, misalnya dalam 1 $cm^{3}$ natrium akan lebih berat dari litium dengan volume yang sama.
(b) Golongan II:
- Titik lelehnya cenderung menurun dengan alasan yang sama seperti golongan 1, meski demikian untuk titik didihnya tidak terlihat tren atau kecenderungan yang pasti.
- Energi atomisasi, yakni energi yang diperlukan untuk menghasilkan 1 mol atom terpisah dalam fase gas dari unsurnya dalam keadaan standar, sebagai contoh untuk magnesium:
$Mg(s)\rightarrow Mg(g)$
Berikut ini tren energi atomisasinya:

Kembali tidak ditemukan tren yang pasti untuk sifat ini pada golongan 2. - Tren potensial reduksi, berkaitan dengan kemudahan suatu atom menerima elektron, sehingga secara umum dalam golongan utama dari atas ke bawah cenderung menurun (sejalan dengan kecenderungan elektronegativitas)
Contoh Soal Sifat Sifat Periodik Unsur dan Pembahasannya
- Perkirakanlah urutan jari-jari atom, EI, dan elektronegativitas unsur-unsur berikut dari yang terendah!
a. $_{11}Na$
b. $_{12}Mg$
c. $_{35}Br$
d. $_{36}Kr$
e. $_{10}Ne$
Jawaban
Pertama-tama kita buat konfigurasi Bohr untuk melihat jumlah kulit:
a. Na : 2, 8, 1
b. Mg : 2, 8, 2
c. Br : 2, 8, 18, 7
d. Kr : 2, 8, 18, 8
e. Ne : 2,8
Kemudian ingat bahwa unsur-unsur gas mulia selalu mempunyai nilai EI yang sangat tinggi, elektronegativitas rendah, dan jari-jari atom yang besar.
Kemudian urutkan trennya sesuai dengan jumlah kulit dan jumlah proton (bila jumlah kulit sama), sehingga didapat:
– jari-jari atom: Ne, Mg, Na, Br, Kr
– energi ionisasi: Na, Mg, Br, Kr, Ne
– elektronegativitas: Kr, Ne, Na, Mg, Br

