Kalau kamu ingin belajar Faktor yang Mempengaruhi Laju Reaksi secara lebih mendalam, coba simak penjelasan yang ada di sini. Setelah menerima materi, kamu bisa langsung mempraktikkannya dengan mengerjakan latihan soal yang telah kami sediakan.
Lewat pembahasan ini, kamu bisa belajar mengenai Faktor yang Mempengaruhi Laju Reaksi. Kamu akan diajak untuk memahami materi dan tentang metode menyelesaikan soal.
Kamu juga akan memperoleh latihan soal interaktif yang tersedia dalam tiga tingkat kesulitan, yaitu mudah, sedang, dan sukar. Tertarik untuk mempelajarinya?
Sekarang, kamu bisa mulai mempelajari materi lewat uraian berikut. Apabila materi ini berguna, bagikan ke teman-teman kamu supaya mereka juga mendapatkan manfaatnya.
Kamu dapat download modul & contoh soal serta kumpulan latihan soal Faktor yang Mempengaruhi Laju Reaksi dalam bentuk pdf pada link dibawah ini:
Definisi
Faktor faktor yang mempengaruhi laju reaksi adalah hal atau keadaan yang berpengaruh pada besarnya kecepatan reaksi kimia.
Dalam halaman ini akan diulans 5 faktor, meski pada umumnya ada 4 faktor yang mempengaruhi laju reaksi.
1. Luas Permukaan
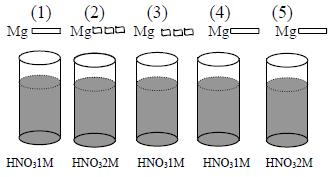
Luas permukaan adalah salah satu faktor yg mempengaruhi laju reaksi. Pada reaksi yang melibatkan suatu zat padat, berdasarkan hasil percobaan diketahui bahwa semakin besar luas permukaan maka semakin besar laju reaksi yang tercatat.
Misalnya reaksi padatan $\mbox{CaCO}_{3}$ dengan larutan asam HCl dibandingkan dengan serbuk $\mbox{CaCO}_{3}$ yang direaksikan dengan HCl.
Maka reaksi akan berjalan lebih cepat jika $\mbox{CaCO}_{3}$ dalam bentuk serbuk, hal ini disebabkan luas permukaan $\mbox{CaCO}_{3}$ serbuk lebih besar daripada $\mbox{CaCO}_{3}$ dalam bentuk padatan.
Mengapa semakin luas permukaan maka semakin cepat reaksi berjalan? Hal ini diakibatkan karena reaksi hanya terjadi pada bidang batas campuran yang disebut bidang sentuh, yang tergantung kepada luas permukaan zat padat.
Semakin besar bidang sentuh maka semakin banyak tumbukan yang terjadi dan semakin cepat reaksi berjalan. Apabila digambarkan perbandingannya sebagai berikut:
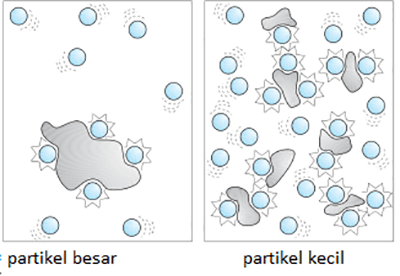
2. Konsentrasi Pereaksi
Konsentrasi pereaksi berkaitan dengan jumlah partikel juga termasuk dalam faktor faktor yang mempengaruhi laju reaksi.
Tentunya, semakin besar konsentrasi pereaksi, semakin banyak jumlah partikelnya di dalam sistem, semakin besar kemungkinan tumbukan efektif terjadi dan menghasilkan reaksi yang lebih cepat.
3. Tekanan/Volume
Pada reaksi yang melibatkan spesi dalam wujud gas, kelajuannya tergantung kepada tekanan/volume (wadah tempat terjadinya reaksi).
Semakin besar tekanan, semakin kecil volume sistem yang akan menyebabkan tumbukan efektif semakin sering dan reaksi bertambah cepat. Sebagai contoh pada reaksi antara gas hidrogen dan nitrogen menghasilkan amonia ($\mbox{NH}_{3}$) berikut:

4. Suhu
Bagaimana suhu menjadi faktor yang mempengaruhi laju reaksi? Pada umumnya, suatu reaksi akan berlangsung semakin cepat dengan kenaikan suhu.
Hal ini disebabkan karena kenaikan suhu menyebabkan energi kinetik partikel pereaksi meningkat, sehingga jumlah partikel dengan energi melebihi energi aktivasi meningkat, tumbukan efektif lebih banyak terjadi dan reaksi berjalan lebih cepat.

Pada umumnya, setiap kenaikan suhu sebesar $10^{\circ}$C, reaksi akan berlangsung 2 kali lebih cepat. Meskipun demikian banyak pula reaksi lainnya dengan pengaruh kenaikan suhu yang berbeda-beda.
$\begin{alignedat}{1}V_{2} & =\Delta V^{\frac{T_{2}-T_{1}}{\Delta T}}\times V_{1}\end{alignedat}
$
Ket:
$V_{2}$: laju akhir
$V_{1}$: laju awal
$T_{2}$: suhu akhir
$T_{1}$: suhu awal
$\Delta V$: faktor laju
$\Delta T$: faktor suhu
Sehingga bila laju reaksi awal diketahui, waktu reaksi yang dibutuhkan setelah kenaikan suhu dapat diketahui lewat perumusan berikut:
$t_{t}=\frac{1}{(\Delta v)^{\frac{\Delta T}{\Delta T^{\circ}}}}\times t_{0}$
$\begin{alignedat}{1}V_{t} & =\frac{1}{t_{t}}\end{alignedat}
$
Dimana,
$t_{t}=$ waktu reaksi setelah kenaikan suhu
$t_{0}=$ waktu reaksi sebelum kenaikan suhu
$\Delta v=$ kenaikan laju reaksi
$\Delta T=$ kenaikan suhu
$\Delta T^{\circ}=$ kenaikan suhu referensi (yang telah diketahui besarnya terhadap $\Delta v)$
$V_{t}=$ laju reaksi pada waktu t
5. Katalis
Katalis adalah zat yang dapat mempercepat laju reaksi, tetapi zat itu sendiri tidak mengalami perubahan (tidak dikonsumsi atau dihabiskan) dalam berjalannya reaksi. Katalis mempercepat jalannya reaksi dengan cara menurunkan energi aktivasi reaksi.
Contoh Soal dan Pembahasan
- Diketahui suatu reaksi antara logam dan asam menghasilkan gas hidrogen yang dilakukan dalam 2 kondisi berbeda menghasilkan 2 kurva berikut:

Bila kurva putus-putus dianggap variasi dari kurva garis tegas, perlakuan apa saja yang mungkin menghasilkan kurva putus-putus tersebut?
Jawaban
Bila dilihat pada kurva putus-putus, laju reaksi mengalami peningkatan yang pesat pada awal reaksi, namun hasil akhir volume gas yang terbentuk adalah tetap, sehingga perlakuan yang mungkin:- Peningkatan suhu
- Memperkecil ukuran partikel logam
- Penggunaan katalis
–
- Suatu reaksi berlangsung tiga kali lebih cepat tiap kenaikan 20 K. Bila suatu reaksi pada $25^{\circ}$C dapat berlangsung selama 5 menit berapakah waktu reaksinya pada $85^{\circ}$C?
Jawaban
$\begin{aligned}t_{t} & =\frac{1}{(\Delta v)^{\frac{\Delta T}{\Delta T^{\circ}}}}\times t_{0}\\
& =\frac{1}{3{}^{\frac{60}{20}}}\times5\mbox{menit}\\
& =0,185\mbox{ menit}
\end{aligned}
$