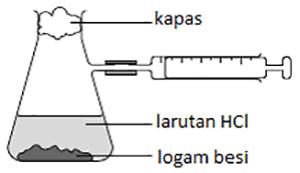
Kalau kamu tertarik untuk mempelajari tentang seluk beluk Pendahuluan Laju Reaksi, simak pembahasannya di sini. Kami juga telah menyiapkan kuis berupa latihan soal dengan tingkatan yang berbeda-beda agar kamu bisa mempraktikkan materi yang telah dipelajari.
Lewat pembahasan ini, kamu bisa belajar mengenai Pendahuluan Laju Reaksi. Kamu akan diajak untuk memahami materi dan tentang metode menyelesaikan soal.
Kamu juga akan memperoleh latihan soal interaktif yang tersedia dalam tiga tingkat kesulitan, yaitu mudah, sedang, dan sukar. Tertarik untuk mempelajarinya?
Sekarang, kamu bisa mulai mempelajari materi lewat uraian berikut. Apabila materi ini berguna, bagikan ke teman-teman kamu supaya mereka juga mendapatkan manfaatnya.
Kamu dapat download modul & contoh soal serta kumpulan latihan soal Pendahuluan Laju Reaksi dalam bentuk pdf pada link dibawah ini:
Definisi
Pengertian laju reaksi kimia adalah perubahan jumlah (massa/ volume/ konsentrasi /mol) suatu reaktan atau produk per waktu.
- Pengukuran laju reaksi : Proses, cara menghitung kecepatan berjalannya suatu reaksi kimia.
- Laju rata-rata: kecepatan reaksi rata-rata untuk selang waktu tertentu.
- Laju sesaat : kecepatan reaksi pada saat tertentu.
Pengertian Laju Reaksi
Suatu reaksi atau proses kimia dapat diamati dari terbentuknya gas, perubahan warna, perubahan massa dan sebagainya.
Dalam menyatakan laju atau kecepatan berjalannya suatu sistem homogen, cara yang umum digunakan adalah laju pengurangan konsentrasi molar pereaksi atau laju pertambahan konsentrasi molar produk dalam satu satuan waktu.
Apabila terdapat reaksi:
$\mbox{A}\rightarrow\mbox{B}$
Maka laju reaksinya dapat dinyatakan dengan persamaan laju reaksi sebagai berikut:
$v=-\frac{\Delta[A]}{\Delta t}$ atau $v=+\frac{\Delta[B]}{\Delta t}$
dimana,
$\mbox{A}=$ pereaksi
$\mbox{B}=$ produk
$v=$ laju reaksi
$t=$ waktu reaksi
$[A]=$ konsentrasi pereaksi (Molar)
$[B]=$ konsentrasi produk (Molar)
Sehingga laju reaksi biasanya dinyatakan dalam satuan Molar per detik atau $\mbox{mol.L}^{-1}\mbox{s}^{-1}$.
Pengukuran Laju Reaksi
Seperti diketahui bahwa laju reaksi dapat ditentukan melalui eksperimen, dimana pengukuran dilakukan pada berkurangnya pereaksi yang dihabiskan serta banyaknya produk yang dihasilkan.
Interval waktu yang disarankan untuk setiap pencatatan data bergantung pada cepat lambatnya reaksi. Untuk reaksi yang berlangsung lambat digunakan interval waktu yang lebih panjang, dan sebaliknya untuk reaksi yang cepat.
Sebagai acuan sederhana, interval waktu yang dipilih sebaiknya tidak menghabiskan lebih dari 5% pereaksi.
Sebagai contoh pengukuran laju reaksi pada reaksi antara logam natrium dan asam klorida, HCl akan menghasilkan gas $\mbox{CO}_{2}$ sesuai reaksi berikut:
$\mbox{CaCO}_{3}+2\mbox{HCl}\rightarrow\mbox{CaCl}_{2}+\mbox{H}_{2}\mbox{O}+\mbox{CO}_{2}$
Laju reaksi dapat ditentukan dari banyaknya gas $\mbox{CO}_{2}$ (dalam satuan volumenya) per waktu berjalannya reaksi.

Setelah didapat data, kita dapat membuat plot dimana sumbu X adalah waktu berjalannya reaksi dan sumbu Y adalah volume gas $\mbox{CO}_{2}$ yang terbentuk. Kurva yang terbentuk kira-kira akan berbentuk sebagai berikut.

Dari kurva yang terbentuk didapat bahwa
- Laju reaksi berubah dari waktu ke waktu. Laju terbesar umumnya terjadi pada awal reaksi dan semakin menurun menuju akhir reaksi
- Kemiringan kurva berubah dari waktu ke waktu sesuai dengan berkurangnya laju reaksi
- Pada waktu tertentu reaksi akan berhenti dan ditandai dengan kurva yang menjadi datar
- Laju reaksi awal dapat diketahui dari data pertama yang diambil
- Laju reaksi rata-rata dapat diketahui dari total volume gas hidrogen yang terbentuk per waktu reaksi yang diperlukan, yakni waktu ketika reaksi sudah berakhir
Pengukuran laju reaksi dapat juga dilakukan dengan pengurangan massa. Perhatikan diagram berikut, reaksi antara $\mbox{CaCO}_{3}$ dengan $\mbox{HCl}$.
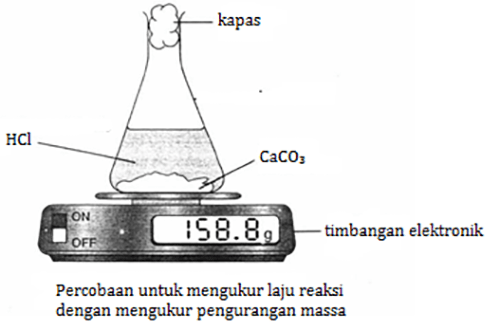
Gas $\mbox{CO}_{2}$ yang terbentuk akan keluar erlenmeyer melalui kapas. Kurva yang terbentuk kira-kira akan berbentuk sebagai berikut.

Laju Rata-Rata dan Sesaat
Apabila diketahui data dari suatu reaksi yang menghasilkan gas oksigen berikut:

Laju reaksi ini dinyatakan dalam laju pertambahan produk, yakni oksigen, dan dapat disajikan sebagai:
1. Laju rata-rata
Laju rata-rata, yakni laju reaksi rata-rata untuk selang waktu tertentu. Misalkan dari data diatas, laju reaksi rata-rata setelah 3 menit adalah:
$\begin{aligned}v & =+\frac{\Delta\mbox{O}_{2}}{\Delta t}\\
& =\frac{33\mbox{cm}^{3}}{3\mbox{menit}}\\
& =11\mbox{cm}^{3}\mbox{menit}^{-1}
\end{aligned}
$
2. Laju sesaat
Laju sesaat, yakni laju reaksi pada saat tertentu. Laju reaksi seiring berjalannya reaksi akan cenderung menurun, oleh karena itu plot laju terhadap waktu berbentuk garis lengkung.
Laju sesaat pada waktu tertentu, $t$, dapat ditentukan dari kemiringan (gradien) garis singgung pada saat $t$ tersebut. Sehingga penentuan laju sesaat dapat dilakukan sebagai berikut:
- Lukis garis singgung pada saat $t$
- Lukis segi tiga untuk menentukan kemiringan
- Laju sesaat = kemiringan garis singgung

Sehingga misalkan untuk data diatas, laju sesaat pada menit ke tiga adalah: (ambil data pada menit ke 4 dan ke dua)
$\begin{aligned}v & =\frac{\Delta C}{\Delta t}\\
& =\frac{38-25}{4-2}\mbox{cm}^{3}\mbox{menit}^{-1}\\
& =6,5\mbox{cm}^{3}\mbox{menit}^{-1}
\end{aligned}
$
Keadaan Transisi
Teori Keadaan Transisi (Transition State Theory) dikembangkan secara bersamaan pada 1935 oleh Henry Eyring, Meredith Evans dan Michael Polanyi. Inti dari teori ini adalah:
- Laju reaksi dapat dipelajari dengan mengamati ‘kompleks teraktivasi’ yang terdapat pada puncak suatu grafik koordinasi reaksi.
- Kompleks teraktivasi ini berada pada kesetimbangan-semu dengan molekul reaktan
- Kompleks teraktivasi dapat berubah menjadi produk dan teori kinetika dapat digunakan untuk menghitung laju perubahan ini.
Kompleks teraktivasi ini pada akhirnya disebut keadaan transisi, yakni kondisi dimana molekul reaktan memiliki energi paling tinggi dalam koordinat reaksinya. Koordinat reaksi itu sendiri adalah plot waktu reaksi (sumbu X) vs energi (sumbu Y). Bila digambarkan sebagai berikut:

Aplikasi Laju Reaksi
Salah satu aplikasi paling penting dalam mempelajari laju reaksi adalah peran katalis dalam dunia industri. Beberapa reaksi penting dalam industri dan contoh aplikasi laju reaksi dalam kehidupan sehari hari akan berjalan sangat lambat pada kondisi normal, bahkan bila suhu ditingkatkan.
Oleh karena itu, untuk mendapatkan efisiensi produksi maksimal perlu dilakukan riset yang mendalam tentang katalis. Selain dalam bidang katalis, berikut ini beberapa aplikasi kinetika kimia lainnya:
- Dalam kehidupan sehari-hari : kayu bakar perlu dipotong-potong terlebih dahulu sebelum dimasukkan ke dalam perapian supaya lebih cepat terbakar.
- Metabolisme makhluk hidup: dalam keadaan normal berbagai reaksi metabolisme akan berjalan sangat lambat dan hampir tidak mungkin. Adanya enzim, yakni suatu katalis yang terdapat di dalam tubuh makhluk hidup menyebabkan reaksi tersebut mampu berjalan dalam laju yang cukup cepat.
- Teknik lingkungan, dalam proses pembuatan suatu plastik yang ‘mudah terurai’. Seberapa cepatkah laju peruraian plastik tersebut di lingkungan luar agar bisa disebut ‘mudah terurai’? Kinetika kimia dapat menjelaskannya.
- Teori kinetik partikel (terutama gas) memiliki penerapan luas dalam berbagai bidang, seperti penyelaman (scuba diving), mesin pendingin, juga mesin-mesin berbasis pembakaran dalam (internal combustion
engine).
Contoh Soal Pendahuluan Laju Reaksi dan Pembahasannya
- Diketahui reaksi sebagai berikut:
$2\mbox{N}_{2}\mbox{O}_{5}\rightarrow4\mbox{NO}_{2}+\mbox{O}_{2}$
Apabila diketahui laju reaksi pembentukan oksigen adalah 0,01 molar per menit, nyatakan laju reaksi dalam konsentrasi spesi-spesi lain yang terlibat!
Jawaban
Laju reaksi dapat dinyatakan dalam penambahan produk atau pengurangan pereaksi per satuan waktu, dan apabila diketahui laju reaksi untuk salah satu spesi, maka untuk spesi lain dapat diketahui sesuai koefisien reaksinya.
Maka, laju reaksi dapat dinyatakan:
$\begin{alignedat}{1}V_{\mbox{N}_{2}\mbox{O}_{5}} & =-\frac{2}{1}\times V_{\mbox{O}_{2}}\\
& =-\frac{2}{1}\times0,01\mbox{ M/menit}\\
& =-0,02\mbox{ M/menit}\\
V_{\mbox{NO}_{2}} & =+\frac{4}{1}\times V_{\mbox{O}_{2}}\\
& =+\frac{4}{1}\times0,01\mbox{ M/menit}\\
& =+0,04\mbox{ M/menit}
\end{alignedat}
$
Tanda positif (+) dan negatif (-) hanya sebagai pertambahan (+) atau pengurangan (-) jumlah. - Sejumlah tertentu logam besi direaksikan dengan asam klorida berlebih. Volume gas hidrogen yang terbentuk dicatat setiap 30 detik dan hasilnya diberikan pada tabel berikut:

Tentukan laju reaksi awal serta laju rata-ratanya!
Jawaban
Laju reaksi awal dapat dilihat dari data pertama:$\begin{aligned}v & =\frac{14\mbox{cm}^{3}}{30\mbox{s}}\\
& =0,467\mbox{cm}^{3}\mbox{s}^{-1}
\end{aligned}
$
Waktu reaksi berakhir ketika gas hidrogen yang terbentuk tidak lagi bertambah, yakni pada detik ke 150, sehingga laju rata-rata:
$\begin{aligned}\bar{v} & =\frac{45\mbox{cm}^{3}}{150\mbox{s}}\\
& =0,3\mbox{cm}^{3}\mbox{s}^{-1}
\end{aligned}
$ - Diketahui data berikut untuk reaksi disosiasi hidrogen peroksida dengan bantuan katalis:
$\mbox{H}_{2}\mbox{O}_{2}\rightarrow\mbox{H}_{2}\mbox{O}+\frac{1}{2}\mbox{O}_{2}$
Tentukanlah laju rata-rata dan laju sesaat pada menit ke-2!
Jawaban
Laju rata-rata:
$\begin{aligned}v & =\frac{37}{120}\mbox{cm}^{3}\mbox{s}^{-1}\\
& =0,308\mbox{cm}^{3}\mbox{s}^{-1}
\end{aligned}
$Laju sesaat, kita ambil data pada detik ke 150 dan 90
$\begin{aligned}v & =\frac{\Delta C}{\Delta t}\\
& =\frac{45-31}{150-90}\mbox{cm}^{3}\mbox{s}^{-1}\\
& =0,233\mbox{cm}^{3}\mbox{s}^{-1}
\end{aligned}
$