Kalau kebetulan kamu ingin belajar lebih tentang Titrasi Asam Basa, kamu bisa menyimak pembahasannya yang ada di sini. Setelahnya, kamu bisa mengerjakan kuis berupa latihan soal untuk mengasah kemampuan belajarmu.
Lewat pembahasan ini, kamu bisa belajar mengenai Titrasi Asam Basa. Kamu akan diajak untuk memahami materi dan tentang metode menyelesaikan soal.
Kamu juga akan memperoleh latihan soal interaktif yang tersedia dalam tiga tingkat kesulitan, yaitu mudah, sedang, dan sukar. Tertarik untuk mempelajarinya?
Sekarang, kamu bisa mulai mempelajari materi lewat uraian berikut. Apabila materi ini berguna, bagikan ke teman-teman kamu supaya mereka juga mendapatkan manfaatnya.
Kamu dapat download modul & contoh soal serta kumpulan latihan soal Titrasi Asam Basa dalam bentuk pdf pada link dibawah ini:
Definisi
Titrasi asam basa merupakan proses penentuan konsentrasi suatu larutan dengan menggunakan reaksi asam basa, di mana konsentrasi salah satu zat udah diketahui.
Titrasi Asam-Basa
Untuk proses analisis konsentrasi suatu larutan, titrasi adalah salah satu cara yang paling mudah dan akurat.
Pada intinya titrasi asam basa adalah adalah proses penentuan konsentrasi suatu larutan dengan mereaksikan larutan yang sudah tertentu konsentrasinya (larutan standar).
Tujuan titrasi asam basa pada titrasi asam basa digunakan reaksi penetralan dengan mengukur volume dari asam atau basa yang bereaksi sehingga proses ini disebut juga titrasi volumetri.
A. Istilah-istilah yang penting pada proses titrasi
Berikut ini istilah-istilah yang penting pada reaksi titrasi asam basa beserta contoh titrasi asam basa:
- Zat peniter : larutan standar yang telah diketahui konsentrasinya, terbagi ke dalam
- primer : ketelitian tinggi, contoh: KHF (Kalium Hidrogen Ftalat)
- sekunder: kemolarannya ditentukan dengan larutan standar primer
- Titik Ekivalen (TE) : pH pada saat asam dan basa tepat habis bereaksi konsentrasi ekivalen dapat dihitung:
$V_{A}\times M_{A}\times n_{A}=V_{B}\times M_{B}\times n_{B}$dimana,$V_{A}=$volume asam$M_{A}=$konsentrasi asam$n_{A}=$valensi asam$V_{B}=$volume basa$M_{B}=$ konsentrasi basa $n_{B}=$ valensi basa
– - Titik Akhir (TA) : pH pada saat indikator berubah warna.
B. Cara atau metode titrasi
Berikut adalah cara atau metode dalam rangkuman titrasi asam basa lengkap sebagai berikut.
- Larutan yang akan diteteskan dimasukkan ke dalam buret (pipa panjang berskala), inilah yang disebut peniter
- Larutan yang akan dititrasi dimasukkan ke dalam erlenmeyer dengan mengukur volumenya terlebih dahulu memakai pipet volume
- Memberikan beberapa tetes indikator pada larutan yang dititrasi, pilih indikator dengan perubahan warna sekitar TE.
- Lakukan titrasi, yaitu larutan yang berada dalam buret diteteskan perlahan-lahan melalui keran ke dalam erlenmeyer sambil digoyang agar merata. Penambahan peniter dihentikan ketika sudah terjadi perubahan warna yang tidak hilang ketika larutan digoyangkan, yang menandakan telah tercapai TA.
- Mencatat volume yang dibutuhkan peniter dengan melihat volume yang berkurang pada buret setelah titrasi.
C. Membuat kurva titrasi
Untuk membuat kurva jenis titrasi asam basa adalah sebagai berikut ini
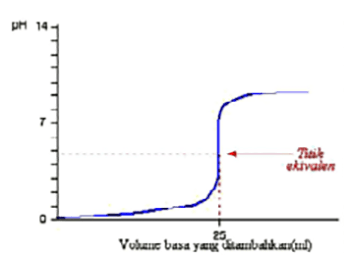
- Titrasi asam kuat oleh basa kuat dan sebaliknya
pH ekivalen adalah 7, sehingga kurva yang akan didapat:

Bila dilakukan titrasi sebaliknya maka bentuk kurva dibalik menghadap kiri (mulai dari pH tinggi) - Titrasi asam kuat oleh basa lemah dan sebaliknya
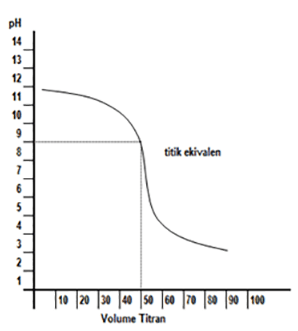
pH ekivalen di bawah 7, sehingga bentuk kurvanya:

Bila dilakukan titrasi sebaliknya (basa lemah oleh asam kuat) maka kurva dibalik menghadap kiri - Titrasi asam lemah oleh basa kuat dan sebaliknya
pH ekivalen di atas 7, sehingga kurvanya:

Bila dilakukan titrasi sebaliknya (basa kuat oleh asam kuat) maka kurva dibalik menghadap kiri.
Titrasi Balik
Dalam materi titrasi asam basa suatu titrasi secara umum dilakukan secara langsung, akan tetapi apabila suatu reaksi berlangsung lambat dan tidak dapat diperoleh titik akhir yang tegas. Maka kita gunakan metode titrasi balik untuk mengatasinya.
Pada metode titrasi balik ini, penentuan konsentrasi analit (zat yang ingin dianalisis) dalam sampel dilakukan dengan cara menambahkan senyawa berlebih yang diketahui konsentrasinya, kemudian kelebihan senyawa yang tidak bereaksi dengan analit dititrasi balik dengan peniter yang tepat.
Bila digambarkan dalam diagram seperti ini: bila A adalah analit, $\mbox{A}+\mbox{B}\rightarrow$C + kelebihan B, kelebihan B + D $\rightarrow$ hasil reaksi. Dari nilai kelebihan B yang bereaksi dengan D inilah kita dapatkan konsentrasi analit.
Sehingga didapat:
- konsentrasi peniter D = konsentrasi B berlebih.
- konsentrasi A = konsentrasi B yang digunakan – konsentrasi B berlebih
Contoh Soal Titrasi Asam Basa dan Pembahasannya
- Suatu sampel $\mbox{Ba(OH)}_{2}$ sebanyak 25 mL tepat dititrasi oleh 100 mL HCl 0,1 M, tentukan konsentrasi sampel tersebut!
Jawaban
$\begin{aligned}V_{A}\times M_{A}\times n_{A} & =V_{B}\times M_{B}\times n_{B}\\
100\times0,1M\times1 & =25\times M_{B}\times2\\
M_{B} & =0,2M
\end{aligned}
$
– - Pada suatu proses fungsi titrasi asam basa, 20 mL HCl sebagai sampel diencerkan hingga volumenya tepat 100 mL. Sebanyak 10 mL dari larutan tersebut diambil dan dititrasi dengan KOH 0,1 M. Dari hasil eksperimen ditemukan bahwa peniter berkurang sebanyak 20 mL. Tentukan konsentrasi sampel awal!
Jawaban
Pertama-tama kita hitung konsentrasi HCl yang dititrasi:
$\begin{aligned}V_{A}\times M_{A}\times n_{A} & =V_{B}\times M_{B}\times n_{B}\\
10\times M_{A}\times1 & =20\times0,1M\times1\\
M_{A} & =0,2M
\end{aligned}
$
–
Ini adalah konsentrasi setelah pengenceran, maka konsentrasi sebelum
pengenceran:
$\begin{aligned}V_{1}M_{1} & =V_{2}M_{2}\\
20\times M_{1} & =100\times0,2M\\
M_{1} & =1M
\end{aligned}
$
– - Suatu sampel 0,500 g yang mengandung $\mbox{Na}_{2}\mbox{CO}_{3}$ dianalisis menggunakan metode titrasi balik dimana pertama-tama ditambahkan 50 mL 0,100 M HCl , dididihkan untuk menghilangkan $\mbox{CO}_{2}$ kemudian dititrasi balik dengan 0,100 M NaOH. Jika diperlukan 5,6 mL NaOH untuk titrasi balik, berapa persen $\mbox{Na}_{2}\mbox{CO}_{3}$ dalam sampel?
Jawaban
Kita mulai dari reaksi titrasi balik:
$\mbox{NaOH}+\mbox{HCl}\rightarrow\mbox{NaCl}+\mbox{H}_{2}\mbox{O}$
sehingga,
$\begin{aligned}\mbox{mol HCl lebih} & =\mbox{mol NaOH}\\
& =0,1\times5,6\mbox{ mmol}\\
& =0,56\mbox{ mmol}
\end{aligned}
$
–
Reaksi awal adalah:
$\mbox{Na}_{2}\mbox{CO}_{3}+2\mbox{HCl}\rightarrow2\mbox{NaCl}+\mbox{CO}_{2}+\mbox{H}_{2}\mbox{O}$
–
Maka, mol $\mbox{Na}_{2}\mbox{CO}_{3}=0,5\times\mbox{HCl bereaksi}$
$\begin{aligned}\mbox{mol }\mbox{Na}_{2}\mbox{CO}_{3} & =0,5\times(50\times0,1-0,56)\mbox{ mmol}\\
& =2,22\mbox{ mmol}\\
m\mbox{Na}_{2}\mbox{CO}_{3} & =2,22\times106\mbox{ mg}\\
& =235,32\mbox{ mg}
\end{aligned}
$
–
Sehingga persentasenya di dalam sampel:
$\frac{235,32}{500}\times100\%=47,064\%$
Latihan Soal Titrasi Asam Basa (Mudah)
Ringkasan kuis
0 dari 5 pertanyaan telah diselesaikan
Pertanyaan:
- 1
- 2
- 3
- 4
- 5
Informasi
You have already completed the quiz before. Hence you can not start it again.
Quiz is loading...
Anda harus masuk atau mendaftar untuk memulai kuis.
Anda harus menyelesaikan kuis dibawah ini, untuk memulai kuis ini:
Hasil
Hasil
0 dari 5 pertanyaan terjawab dengan benar
Waktu yang telah berlalu
Kategori
- Tidak Berkategori 0%
- 1
- 2
- 3
- 4
- 5
- Terjawab
- Tinjau
-
Pertanyaan ke 1 dari 5
1. Pertanyaan
Berapakah volume NaOH 0,1 M yang diperlukan untuk menetralkan 10 mL $\mbox{HC}\ell$ 0,1 M ?
Betul$\begin{alignedat}{1}M_{1}\cdot V_{1} & =M_{2}\cdot V_{2}\\
0,1\times V_{1} & =0,1\times10\mbox{ mL}\\
V_{1} & =10\mbox{ mL}
\end{alignedat}
$Salah$\begin{alignedat}{1}M_{1}\cdot V_{1} & =M_{2}\cdot V_{2}\\
0,1\times V_{1} & =0,1\times10\mbox{ mL}\\
V_{1} & =10\mbox{ mL}
\end{alignedat}
$ -
Pertanyaan ke 2 dari 5
2. Pertanyaan
Grafik titrasi berikut untuk titrasi larutan $\mbox{NH}_{3}$ dengan larutan $\mbox{HC}\ell$ adalah …
Betul$\mbox{NH}_{3}$ adalah basa lemah dan $\mbox{HC}\ell$ adalah asam kuat. sehingga titik ekivalennya dibawah pH 7.
Salah$\mbox{NH}_{3}$ adalah basa lemah dan $\mbox{HC}\ell$ adalah asam kuat. sehingga titik ekivalennya dibawah pH 7.
-
Pertanyaan ke 3 dari 5
3. Pertanyaan
Indikator yang paling tepat digunakan untuk titrasi $\mbox{H}_{2}\mbox{SO}_{4}$ dengan $\mbox{NH}_{3}$ adalah … .
Betul$\mbox{H}_{2}\mbox{SO}_{4}$ merupakan asam kuat dan $\mbox{NH}_{3}$ adalah basa lemah, sehingga titik ekivalen titrasi berada di bawah $pH=7$.
Salah$\mbox{H}_{2}\mbox{SO}_{4}$ merupakan asam kuat dan $\mbox{NH}_{3}$ adalah basa lemah, sehingga titik ekivalen titrasi berada di bawah $pH=7$.
-
Pertanyaan ke 4 dari 5
4. Pertanyaan
Pada suatu titrasi diperoleh titik akhir titrasi pada pH = 5. Indikator yang sesuai untuk titrasi ini adalah … .
BetulIndikator yang digunakan untuk titrasi harus berada di kisaran titik akhir titrasi.
SalahIndikator yang digunakan untuk titrasi harus berada di kisaran titik akhir titrasi.
-
Pertanyaan ke 5 dari 5
5. Pertanyaan
Pada suatu titrasi diperoleh grafik titrasi sebagai berikut.

Pasangan zat peniter dan titran yang menghasilkan grafik tersebut adalah … .
BetulDari grafik dapat disimpulkan bahwa titik ekivalen sedikit basa, sehingga reaksi yang terjadi adalah asam lemah dan basa kuat.
$\mbox{CH}_{3}\mbox{COOH}$ : asam lemah.
$\mbox{NaOH}$ : basa kuat.SalahDari grafik dapat disimpulkan bahwa titik ekivalen sedikit basa, sehingga reaksi yang terjadi adalah asam lemah dan basa kuat.
$\mbox{CH}_{3}\mbox{COOH}$ : asam lemah.
$\mbox{NaOH}$ : basa kuat.
Latihan Soal Titrasi Asam Basa (Sedang)
Ringkasan kuis
0 dari 5 pertanyaan telah diselesaikan
Pertanyaan:
- 1
- 2
- 3
- 4
- 5
Informasi
You have already completed the quiz before. Hence you can not start it again.
Quiz is loading...
Anda harus masuk atau mendaftar untuk memulai kuis.
Anda harus menyelesaikan kuis dibawah ini, untuk memulai kuis ini:
Hasil
Hasil
0 dari 5 pertanyaan terjawab dengan benar
Waktu yang telah berlalu
Kategori
- Tidak Berkategori 0%
- 1
- 2
- 3
- 4
- 5
- Terjawab
- Tinjau
-
Pertanyaan ke 1 dari 5
1. Pertanyaan
$x$ gram padatan NaOH dilarutkan dalam air sehingga volume larutan 500 mL. Diperlukan sejumlah 25 mL larutan $\mbox{HC}\ell$ 0,1 M untuk menetralkan 20 mL larutan NaOH tersebut. Berapakah nilai $x$ ?
Betul$\begin{alignedat}{1}\mbox{n HC}\ell & =M\times V\\
& =0,1\times0,025\mbox{ mol}\\
& =0,0025\mbox{ mol}
\end{alignedat}
$ $\begin{array}{ccc}
\mbox{NaOH}(aq) & + & \mbox{HC}\ell(aq)\\
0,0025\mbox{ mol} & & 0,0025\mbox{ mol}
\end{array}$ $\begin{array}{cc}
\rightarrow & \mbox{NaC}\ell(aq)\\
\\
\end{array}$ $\begin{array}{cc}
+ & \mbox{H}_{2}\mbox{O}(\ell)\\
\\
\end{array}$Jumlah mol NaOH dalam 20 mL larutan = 0,0025 mol. Sehingga, jumlah mol dalm 500 mL larutan:
$\begin{alignedat}{1}n\mbox{NaOH} & =\frac{500}{20}\times0,0025\mbox{ mol}\\
& =0,0625\mbox{ mol}\\
m\mbox{NaOH} & =n\times M_{r}\mbox{NaOH}\\
& =0,0625\times40\mbox{ gram}\\
& =2,5\mbox{ gram}.
\end{alignedat}
$Salah$\begin{alignedat}{1}\mbox{n HC}\ell & =M\times V\\
& =0,1\times0,025\mbox{ mol}\\
& =0,0025\mbox{ mol}
\end{alignedat}
$ $\begin{array}{ccc}
\mbox{NaOH}(aq) & + & \mbox{HC}\ell(aq)\\
0,0025\mbox{ mol} & & 0,0025\mbox{ mol}
\end{array}$ $\begin{array}{cc}
\rightarrow & \mbox{NaC}\ell(aq)\\
\\
\end{array}$ $\begin{array}{cc}
+ & \mbox{H}_{2}\mbox{O}(\ell)\\
\\
\end{array}$Jumlah mol NaOH dalam 20 mL larutan = 0,0025 mol. Sehingga, jumlah mol dalm 500 mL larutan:
$\begin{alignedat}{1}n\mbox{NaOH} & =\frac{500}{20}\times0,0025\mbox{ mol}\\
& =0,0625\mbox{ mol}\\
m\mbox{NaOH} & =n\times M_{r}\mbox{NaOH}\\
& =0,0625\times40\mbox{ gram}\\
& =2,5\mbox{ gram}.
\end{alignedat}
$ -
Pertanyaan ke 2 dari 5
2. Pertanyaan
Pada suatu percobaan 40 $\mbox{cm}^{3}$ garam hidrat $\mbox{Na}_{2}\mbox{CO}_{3}\cdot x\mbox{H}_{2}\mbox{O}$ dengan konsentrasi 7,15 $\mbox{gram/dm}^{3}$ bereaksi habis dengan 20 $\mbox{cm}^{3}$ larutan $\mbox{HC}\ell$ 0,1 $\mbox{mol/dm}^{3}$. Tentukan nilai $x$.
Betul$\begin{array}{c}
\mbox{Na}_{2}\mbox{CO}_{3}\\
\\
\frac{1}{2}\times0,002\mbox{ mol}\\
=0,001\mbox{ mol}\\
\mbox{Na}_{2}\mbox{CO}_{3}\cdot x\mbox{H}_{2}\mbox{O}\\
0,001\mbox{ mol}
\end{array}$ $\begin{array}{cc}
+ & \mbox{2HC}\ell\\
& 0,1\mbox{ mol/dm}^{3};0,02\mbox{ dm}^{3}\\
\\
& =0,002\mbox{ mol}\\
\rightarrow & \mbox{Na}_{2}\mbox{CO}_{3}\\
& 0,001\mbox{ mol}
\end{array}$ $\begin{array}{cc}
\rightarrow & \mbox{2NaC}\ell\\
\\
\\
\\
+ & x\mbox{H}_{2}\mbox{O}\\
\\
\end{array}$ $\begin{array}{cc}
+ & \mbox{H}_{2}\mbox{O}\\
\\
\\
\\
\\
\\
\end{array}$Menentukan jumlah massa dalam 40 $\mbox{cm}^{3}$
$\begin{aligned}n_{\mbox{Na}_{2}\mbox{CO}_{3}} & =0,001\mbox{ mol}\\
m_{\mbox{Na}_{2}\mbox{CO}_{3}\cdot x\mbox{H}_{2}\mbox{O}} & =7,15\mbox{ gram/dm}^{3}\times0,04\mbox{ dm}^{3}\\
& =0,286\mbox{ gram}
\end{aligned}
$$\begin{alignedat}{1}M_{r}\mbox{Na}_{2}\mbox{CO}_{3}\cdot x\mbox{H}_{2}\mbox{O} & =\frac{\mbox{m}}{\mbox{mol}}\\
& =\frac{0,286}{0,001}\\
& =286
\end{alignedat}
$$M_{r}\mbox{Na}_{2}\mbox{CO}_{3}\cdot x\mbox{H}_{2}\mbox{O}$ $=(2\times A_{r}\mbox{Na})+A_{r}\mbox{ C}$
$+(3\times A_{r}\mbox{ O})$ $+x\left((2\times A_{r}\mbox{H})+A_{r}\mbox{O}\right)$$\begin{aligned}286 & =46+12+48+18x\\
x & =\frac{286-106}{18}\\
& =10.
\end{aligned}
$Salah$\begin{array}{c}
\mbox{Na}_{2}\mbox{CO}_{3}\\
\\
\frac{1}{2}\times0,002\mbox{ mol}\\
=0,001\mbox{ mol}\\
\mbox{Na}_{2}\mbox{CO}_{3}\cdot x\mbox{H}_{2}\mbox{O}\\
0,001\mbox{ mol}
\end{array}$ $\begin{array}{cc}
+ & \mbox{2HC}\ell\\
& 0,1\mbox{ mol/dm}^{3};0,02\mbox{ dm}^{3}\\
\\
& =0,002\mbox{ mol}\\
\rightarrow & \mbox{Na}_{2}\mbox{CO}_{3}\\
& 0,001\mbox{ mol}
\end{array}$ $\begin{array}{cc}
\rightarrow & \mbox{2NaC}\ell\\
\\
\\
\\
+ & x\mbox{H}_{2}\mbox{O}\\
\\
\end{array}$ $\begin{array}{cc}
+ & \mbox{H}_{2}\mbox{O}\\
\\
\\
\\
\\
\\
\end{array}$Menentukan jumlah massa dalam 40 $\mbox{cm}^{3}$
$\begin{aligned}n_{\mbox{Na}_{2}\mbox{CO}_{3}} & =0,001\mbox{ mol}\\
m_{\mbox{Na}_{2}\mbox{CO}_{3}\cdot x\mbox{H}_{2}\mbox{O}} & =7,15\mbox{ gram/dm}^{3}\times0,04\mbox{ dm}^{3}\\
& =0,286\mbox{ gram}
\end{aligned}
$$\begin{alignedat}{1}M_{r}\mbox{Na}_{2}\mbox{CO}_{3}\cdot x\mbox{H}_{2}\mbox{O} & =\frac{\mbox{m}}{\mbox{mol}}\\
& =\frac{0,286}{0,001}\\
& =286
\end{alignedat}
$$M_{r}\mbox{Na}_{2}\mbox{CO}_{3}\cdot x\mbox{H}_{2}\mbox{O}$ $=(2\times A_{r}\mbox{Na})+A_{r}\mbox{ C}$
$+(3\times A_{r}\mbox{ O})$ $+x\left((2\times A_{r}\mbox{H})+A_{r}\mbox{O}\right)$$\begin{aligned}286 & =46+12+48+18x\\
x & =\frac{286-106}{18}\\
& =10.
\end{aligned}
$ -
Pertanyaan ke 3 dari 5
3. Pertanyaan
Sejumlah $\mbox{HC}\ell$ dilarutkan dalam air sehingga volume larutannya 250 mL. 10 mL larutan $\mbox{HC}\ell$ tersebut diambil kemudian diencerkan menjadi 50 mL. 5 mL larutan ini dapat dinetralkan 15 mL larutan NaOH 0,02 M. Tentukan konsentrasi larutan $\mbox{HC}\ell$ mula-mula.
Betul$\begin{array}{c}
\mbox{NaOH}\\
0,02\mbox{M}\times0,015\mbox{L}\\
=3\times10^{-4}\mbox{mol}
\end{array}$ $\begin{array}{cc}
+ & \mbox{HC}\ell\\
\\
& 3\times10^{-4}\mbox{mol}
\end{array}$ $\begin{array}{cc}
\rightarrow & \mbox{NaOH+H}_{2}\mbox{O}\\
\\
\\
\end{array}$$\begin{alignedat}{1}n_{\mbox{HC}\ell}(5\mbox{ mL}) & =3\times10^{-4}\mbox{mol}\\
n_{\mbox{HC}\ell}(50\mbox{ mL}) & =\frac{50}{5}\times3\times10^{-4}\mbox{mol}\\
& =3\times10^{-3}\mbox{mol}
\end{alignedat}
$$n_{\mbox{HC}\ell}(10\mbox{ mL})$$=n_{\mbox{HC}\ell}(50\mbox{ mL})$ (karena pengenceran sehingga jumlah mol sama)
$\begin{alignedat}{1}n_{\mbox{HC}\ell}(250\mbox{ mL}) & =\frac{250}{10}\times3\times10^{-3}\mbox{ mol}\\
& =7,5\times10^{-2}\mbox{ mol}\\
\mbox{[HC}\ell]_{\mbox{awal}} & =\frac{n}{V}\\
& =\frac{7,5\times10^{-2}\mbox{mol}}{0,25\mbox{ L}}\\
& =0,3\mbox{ M.}
\end{alignedat}
$Salah$\begin{array}{c}
\mbox{NaOH}\\
0,02\mbox{M}\times0,015\mbox{L}\\
=3\times10^{-4}\mbox{mol}
\end{array}$ $\begin{array}{cc}
+ & \mbox{HC}\ell\\
\\
& 3\times10^{-4}\mbox{mol}
\end{array}$ $\begin{array}{cc}
\rightarrow & \mbox{NaOH+H}_{2}\mbox{O}\\
\\
\\
\end{array}$$\begin{alignedat}{1}n_{\mbox{HC}\ell}(5\mbox{ mL}) & =3\times10^{-4}\mbox{mol}\\
n_{\mbox{HC}\ell}(50\mbox{ mL}) & =\frac{50}{5}\times3\times10^{-4}\mbox{mol}\\
& =3\times10^{-3}\mbox{mol}
\end{alignedat}
$$n_{\mbox{HC}\ell}(10\mbox{ mL})$$=n_{\mbox{HC}\ell}(50\mbox{ mL})$ (karena pengenceran sehingga jumlah mol sama)
$\begin{alignedat}{1}n_{\mbox{HC}\ell}(250\mbox{ mL}) & =\frac{250}{10}\times3\times10^{-3}\mbox{ mol}\\
& =7,5\times10^{-2}\mbox{ mol}\\
\mbox{[HC}\ell]_{\mbox{awal}} & =\frac{n}{V}\\
& =\frac{7,5\times10^{-2}\mbox{mol}}{0,25\mbox{ L}}\\
& =0,3\mbox{ M.}
\end{alignedat}
$ -
Pertanyaan ke 4 dari 5
4. Pertanyaan
30 mL larutan asam sulfat pekat $(\rho=1.82\mbox{ gr/mL})$ diencerkan dalam air sehingga volume larutan menjadi 6 L. 20 mL larutan tersebut dinetralkan dengan 20 mL larutan KOH 0,15 M. Tentukan kadar asam sulfat
tersebut.BetulMenghitung massa teoritis asam sulfat
$\begin{alignedat}{1}m & =\rho\times V\\
& =1,82\mbox{ gr/mL}\times30\mbox{ mL}\\
& =54,6\mbox{ gram}
\end{alignedat}
$Menghitung massa asam sulfat dari reaksi:
$\begin{array}{c}
\mbox{2KOH}(aq)\\
0,15\mbox{ M}\times0,02\mbox{ L}\\
=3\times10^{-3}\mbox{mol}\\
\\
\end{array}$ $\begin{array}{cc}
+ & \mbox{H}_{2}\mbox{SO}_{4}(aq)\\
\\
& \frac{1}{2}\times3\times10^{-3}\mbox{mol}\\
& =1,5\times10^{-3}\mbox{mol}
\end{array}$ $\begin{array}{cc}
\rightarrow & \mbox{K}_{2}\mbox{SO}_{4}(aq)+2\mbox{H}_{2}\mbox{O}(\ell)\\
\\
\\
\\
\end{array}$$\begin{aligned}n_{\mbox{H}_{2}\mbox{SO}_{4}}(20\mbox{ mL}) & =1,5\times10^{-3}\mbox{ mol}\\
n_{\mbox{H}_{2}\mbox{SO}_{4}}(6\mbox{ L}) & =\frac{6000\mbox{ mL}}{20\mbox{ mL}}\times1,5\times10^{-3}\mbox{mol}\\
& =0,45\mbox{ mol}\\
n_{\mbox{H}_{2}\mbox{SO}_{4}}(6\mbox{ L}) & =n_{\mbox{H}_{2}\mbox{SO}_{4}}(30\mbox{ mL})(\mbox{karena pengenceran})\\
& =0,45\mbox{ mol}
\end{aligned}
$$\begin{alignedat}{1}m_{\mbox{H}_{2}\mbox{SO}_{4}} & =n\times M_{r}\\
& =0,45\times98\mbox{ gram}\\
& =44,1\mbox{ gram}\\
\%\mbox{H}_{2}\mbox{SO}_{4} & =\frac{44,1}{54,6}\times100\%\\
& =80,77\%.
\end{alignedat}
$SalahMenghitung massa teoritis asam sulfat
$\begin{alignedat}{1}m & =\rho\times V\\
& =1,82\mbox{ gr/mL}\times30\mbox{ mL}\\
& =54,6\mbox{ gram}
\end{alignedat}
$Menghitung massa asam sulfat dari reaksi:
$\begin{array}{c}
\mbox{2KOH}(aq)\\
0,15\mbox{ M}\times0,02\mbox{ L}\\
=3\times10^{-3}\mbox{mol}\\
\\
\end{array}$ $\begin{array}{cc}
+ & \mbox{H}_{2}\mbox{SO}_{4}(aq)\\
\\
& \frac{1}{2}\times3\times10^{-3}\mbox{mol}\\
& =1,5\times10^{-3}\mbox{mol}
\end{array}$ $\begin{array}{cc}
\rightarrow & \mbox{K}_{2}\mbox{SO}_{4}(aq)+2\mbox{H}_{2}\mbox{O}(\ell)\\
\\
\\
\\
\end{array}$$\begin{aligned}n_{\mbox{H}_{2}\mbox{SO}_{4}}(20\mbox{ mL}) & =1,5\times10^{-3}\mbox{ mol}\\
n_{\mbox{H}_{2}\mbox{SO}_{4}}(6\mbox{ L}) & =\frac{6000\mbox{ mL}}{20\mbox{ mL}}\times1,5\times10^{-3}\mbox{mol}\\
& =0,45\mbox{ mol}\\
n_{\mbox{H}_{2}\mbox{SO}_{4}}(6\mbox{ L}) & =n_{\mbox{H}_{2}\mbox{SO}_{4}}(30\mbox{ mL})(\mbox{karena pengenceran})\\
& =0,45\mbox{ mol}
\end{aligned}
$$\begin{alignedat}{1}m_{\mbox{H}_{2}\mbox{SO}_{4}} & =n\times M_{r}\\
& =0,45\times98\mbox{ gram}\\
& =44,1\mbox{ gram}\\
\%\mbox{H}_{2}\mbox{SO}_{4} & =\frac{44,1}{54,6}\times100\%\\
& =80,77\%.
\end{alignedat}
$ -
Pertanyaan ke 5 dari 5
5. Pertanyaan
Sampel KOH sebanyak 6 gram dilarutkan dalam air sehingga volume larutan 100 mL. 25 mL larutan tersebut dititrasi dengan larutan 50 mL $\mbox{H}_{2}\mbox{SO}_{4}$ 0,2 M. Tentukan kadar KOH dalam sampel tersebut. ($A_{r}$ K = 39, O = 16, H = 1)
Betul$\begin{alignedat}{1}n_{\mbox{H}_{2}\mbox{SO}_{4}} & =M\times V\\
& =0,2\times0,05\mbox{ mol}\\
& =0,01\mbox{ mol}
\end{alignedat}
$$\begin{array}{c}
\mbox{2KOH}(aq)\\
\frac{2}{1}\times0,01\mbox{ mol}\\
=0,02\mbox{ mol}
\end{array}$ $\begin{array}{cc}
+ & \mbox{H}_{2}\mbox{SO}_{4}(aq)\\
& 0,01\mbox{ mol}\\
\\
\end{array}$ $\begin{array}{cc}
\rightarrow & \mbox{K}_{2}\mbox{SO}_{4}(aq)\\
\\
\\
\end{array}$ $\begin{array}{cc}
+ & 2\mbox{H}_{2}\mbox{O}(\ell)\\
\\
\\
\end{array}$Jumlah mol KOH dalam 100 mL $=\frac{100}{25}\times0,02\mbox{ mol}$ $=0,08\mbox{ mol}$
$\begin{alignedat}{1}m_{\mbox{KOH}} & =n\times M_{r}\\
& =0,08\times56\mbox{ gram}\\
& =4,48\mbox{ gram}\\
\%\mbox{KOH} & =\frac{4,48}{6}\times100\%\\
& =74,7\%.
\end{alignedat}
$Salah$\begin{alignedat}{1}n_{\mbox{H}_{2}\mbox{SO}_{4}} & =M\times V\\
& =0,2\times0,05\mbox{ mol}\\
& =0,01\mbox{ mol}
\end{alignedat}
$$\begin{array}{c}
\mbox{2KOH}(aq)\\
\frac{2}{1}\times0,01\mbox{ mol}\\
=0,02\mbox{ mol}
\end{array}$ $\begin{array}{cc}
+ & \mbox{H}_{2}\mbox{SO}_{4}(aq)\\
& 0,01\mbox{ mol}\\
\\
\end{array}$ $\begin{array}{cc}
\rightarrow & \mbox{K}_{2}\mbox{SO}_{4}(aq)\\
\\
\\
\end{array}$ $\begin{array}{cc}
+ & 2\mbox{H}_{2}\mbox{O}(\ell)\\
\\
\\
\end{array}$Jumlah mol KOH dalam 100 mL $=\frac{100}{25}\times0,02\mbox{ mol}$ $=0,08\mbox{ mol}$
$\begin{alignedat}{1}m_{\mbox{KOH}} & =n\times M_{r}\\
& =0,08\times56\mbox{ gram}\\
& =4,48\mbox{ gram}\\
\%\mbox{KOH} & =\frac{4,48}{6}\times100\%\\
& =74,7\%.
\end{alignedat}
$
Latihan Soal Titrasi Asam Basa (Sukar)
Ringkasan kuis
0 dari 5 pertanyaan telah diselesaikan
Pertanyaan:
- 1
- 2
- 3
- 4
- 5
Informasi
You have already completed the quiz before. Hence you can not start it again.
Quiz is loading...
Anda harus masuk atau mendaftar untuk memulai kuis.
Anda harus menyelesaikan kuis dibawah ini, untuk memulai kuis ini:
Hasil
Hasil
0 dari 5 pertanyaan terjawab dengan benar
Waktu yang telah berlalu
Kategori
- Tidak Berkategori 0%
- 1
- 2
- 3
- 4
- 5
- Terjawab
- Tinjau
-
Pertanyaan ke 1 dari 5
1. Pertanyaan
Sebanyak 1,5 gram sampel batuan mengandung kalsium karbonat $(\mbox{CaCO}_{3})$ dipanaskan hingga hanya terdapat 1 gram padatan. Padatan ini kemudian dilarutkan ke dalam air sehingga terbentuk 20 $\mbox{cm}^{3}$ larutan yang kemudian dititrasi dengan 1,25 M larutan $\mbox{HC}\ell$ ternyata diperlukan 20 $\mbox{cm}^{3}$. Tentukan persen $\mbox{CaCO}_{3}$ yang terdapat dalam sampel batuan tersebut.
BetulReaksi yang terjadi:
– Pada saat pemanasan: $\mbox{CaCO}_{3}(s)$$\rightarrow\mbox{CaO}(s)$ $+\mbox{CO}_{2}(g)$
– Pada pelarutan dengan air: $\mbox{CaO}(s)+\mbox{H}_{2}\mbox{O}(\ell)$ $\rightarrow\mbox{Ca(OH)}_{2}(aq)$
– Titrasi dengan asam: $\mbox{Ca(OH)}_{2}(aq)$ $+\mbox{2HC}\ell(aq)$ $\rightarrow\mbox{CaC}\ell_{2}(aq)$ $+2\mbox{H}_{2}\mbox{O}(\ell)$
Perhitungan dimulai dari titrasi.
$\begin{array}{c}
\mbox{Ca(OH)}_{2}(aq)\\
\\
\frac{1}{2}\times0,025\\
=0,0125\mbox{ mol}\\
\\
\mbox{CaO}(s)\\
0,0125\mbox{ mol}\\
\\
\mbox{CaCO}_{3}(s)\\
0,0125\mbox{ mol}\\
\\
\end{array}$$\begin{array}{cc}
+ & \mbox{2HC}\ell(aq)\\
& 1,25\mbox{ M}\times0,02\mbox{ L}\\
& =0,025\mbox{ mol}\\
\\
\\
+ & \mbox{H}_{2}\mbox{O}(\ell)\\
\\
\\
\rightarrow & \mbox{CaO}(s)\\
& 0,0125\mbox{ mol}\\
\\
\end{array}$$\begin{array}{cc}
\rightarrow & +\mbox{CaC}\ell_{2}(aq)+2\mbox{H}_{2}\mbox{O}(\ell)\\
\\
\\
\\
\\
\rightarrow & \mbox{Ca(OH)}_{2}(aq)\\
& 0,0125\mbox{ mol}\\
\\
+ & \mbox{CO}_{2}(g)\\
\\
\\
\end{array}$$\begin{alignedat}{1}m_{\mbox{CaCO}_{3}} & =n\times M_{r}\mbox{CaCO}_{3}\\
& =0,0125\times100\mbox{ gram}\\
& =1,25\mbox{ gram}\\
\%\mbox{CaCO}_{3} & =\frac{1,25}{1,5}\times100\%\\
& =83,33\%.
\end{alignedat}
$SalahReaksi yang terjadi:
– Pada saat pemanasan: $\mbox{CaCO}_{3}(s)$$\rightarrow\mbox{CaO}(s)$ $+\mbox{CO}_{2}(g)$
– Pada pelarutan dengan air: $\mbox{CaO}(s)+\mbox{H}_{2}\mbox{O}(\ell)$ $\rightarrow\mbox{Ca(OH)}_{2}(aq)$
– Titrasi dengan asam: $\mbox{Ca(OH)}_{2}(aq)$ $+\mbox{2HC}\ell(aq)$ $\rightarrow\mbox{CaC}\ell_{2}(aq)$ $+2\mbox{H}_{2}\mbox{O}(\ell)$
Perhitungan dimulai dari titrasi.
$\begin{array}{c}
\mbox{Ca(OH)}_{2}(aq)\\
\\
\frac{1}{2}\times0,025\\
=0,0125\mbox{ mol}\\
\\
\mbox{CaO}(s)\\
0,0125\mbox{ mol}\\
\\
\mbox{CaCO}_{3}(s)\\
0,0125\mbox{ mol}\\
\\
\end{array}$$\begin{array}{cc}
+ & \mbox{2HC}\ell(aq)\\
& 1,25\mbox{ M}\times0,02\mbox{ L}\\
& =0,025\mbox{ mol}\\
\\
\\
+ & \mbox{H}_{2}\mbox{O}(\ell)\\
\\
\\
\rightarrow & \mbox{CaO}(s)\\
& 0,0125\mbox{ mol}\\
\\
\end{array}$$\begin{array}{cc}
\rightarrow & +\mbox{CaC}\ell_{2}(aq)+2\mbox{H}_{2}\mbox{O}(\ell)\\
\\
\\
\\
\\
\rightarrow & \mbox{Ca(OH)}_{2}(aq)\\
& 0,0125\mbox{ mol}\\
\\
+ & \mbox{CO}_{2}(g)\\
\\
\\
\end{array}$$\begin{alignedat}{1}m_{\mbox{CaCO}_{3}} & =n\times M_{r}\mbox{CaCO}_{3}\\
& =0,0125\times100\mbox{ gram}\\
& =1,25\mbox{ gram}\\
\%\mbox{CaCO}_{3} & =\frac{1,25}{1,5}\times100\%\\
& =83,33\%.
\end{alignedat}
$ -
Pertanyaan ke 2 dari 5
2. Pertanyaan
5 gram pupuk amonium sulfat $\left(\mbox{NH}_{4}\right)_{2}\mbox{SO}_{4}$ dilarutkan dalam air hingga volumenya 500 mL. 20 mL dari larutan tersebut direaksikan dengan larutan KOH berdasarkan reaksi berikut.
$\left(\mbox{NH}_{4}\right)_{2}\mbox{SO}_{4}\mbox{+KOH}$$\rightarrow\mbox{K}_{2}\mbox{SO}_{4}+2\mbox{NH}_{3}$$+\mbox{2H}_{2}\mbox{O}$
Gas amonia yang dihasilkan dialirkan ke dalam 25 mL larutan $\mbox{HC}\ell$ 0,2 M, dan larutan tersebut dapat dinetralkan dengan 20 mL larutan NaOH 0,15 M. Tentukan kadar amonium sulfat dalam pupuk tersebut.
Betul$\begin{alignedat}{1}\mbox{mol NaOH} & =M\times V\\
& =0,02\times0,15\mbox{ mol}\\
& =0,003\mbox{ mol}
\end{alignedat}
$$\begin{array}{c}
\mbox{HC}\ell\\
0,003\mbox{ mol}
\end{array}$ $\begin{array}{cc}
+ & \mbox{NaOH}\\
& 0,003\mbox{ mol}
\end{array}$ $\begin{array}{cc}
\rightarrow & \mbox{NaC}\ell\\
\\
\end{array}$ $\begin{array}{cc}
+ & \mbox{H}_{2}\mbox{O}\\
\\
\end{array}$Menentukan mol $\mbox{HC}\ell$ yang bereaksi dengan $\mbox{NH}_{3}$dari reaksi NaOH dengan $\mbox{HC}\ell$sisa.
$\begin{alignedat}{1}\mbox{mol HC}\ell_{\mbox{awal}} & =M\times V\\
& =0,2\times0,025\mbox{ mol}\\
& =0,005\mbox{ mol}
\end{alignedat}
$$\begin{array}{cc}
& \mbox{NH}_{3}\\
\mbox{awal} & 0,002\mbox{ mol}\\
\mbox{reaksi} & 0,002\mbox{ mol}\\
\mbox{setelah reaksi}
\end{array}$ $\begin{array}{cc}
+ & \mbox{HC}\ell\\
& 0,005\mbox{ mol}\\
& 0,002\mbox{ mol}\\
& 0,003\mbox{ mol}
\end{array}$ $\begin{array}{cc}
\rightarrow & \mbox{NH}_{4}\mbox{C}\ell\\
\\
& 0,002\mbox{ mol}\\
& 0,002\mbox{ mol}
\end{array}$Menentukan jumlah mol $\left(\mbox{NH}_{4}\right)_{2}\mbox{SO}_{4}$ dalam 20 mL larutan
$\begin{array}{c}
\left(\mbox{NH}_{4}\right)_{2}\mbox{SO}_{4}\\
\frac{1}{2}\times0,002\mbox{ mol}\\
=0,001\mbox{ mol}
\end{array}$ $\begin{array}{cc}
+ & \mbox{KOH}\\
\\
\\
\end{array}$ $\begin{array}{cc}
\rightarrow & \mbox{K}_{2}\mbox{SO}_{4}\\
\\
\\
\end{array}$ $\begin{array}{cc}
+ & \mbox{2H}_{2}\mbox{O}\\
\\
\\
\end{array}$ $\begin{array}{cc}
+ & \mbox{2NH}_{3}\\
& 0,002\mbox{ mol}\\
\\
\end{array}$Menentukan jumlah mol $\left(\mbox{NH}_{4}\right)_{2}\mbox{SO}_{4}$ dalam 500 mL,
$\begin{aligned}\mbox{mol}\left(\mbox{NH}_{4}\right)_{2}\mbox{SO}_{4} & =\frac{500}{20}\times0,001\mbox{ mol}\\
& =0,025\mbox{ mol}\\
\mbox{massa}\left(\mbox{NH}_{4}\right)_{2}\mbox{SO}_{4} & =n\times M_{r}\\
& =0,025\times132\mbox{ gram}\\
& =3,3\mbox{ gram}\\
\%\left(\mbox{NH}_{4}\right)_{2}\mbox{SO}_{4} & =\frac{3,3}{5}\times100\%\\
& =66\%.
\end{aligned}
$Salah$\begin{alignedat}{1}\mbox{mol NaOH} & =M\times V\\
& =0,02\times0,15\mbox{ mol}\\
& =0,003\mbox{ mol}
\end{alignedat}
$$\begin{array}{c}
\mbox{HC}\ell\\
0,003\mbox{ mol}
\end{array}$ $\begin{array}{cc}
+ & \mbox{NaOH}\\
& 0,003\mbox{ mol}
\end{array}$ $\begin{array}{cc}
\rightarrow & \mbox{NaC}\ell\\
\\
\end{array}$ $\begin{array}{cc}
+ & \mbox{H}_{2}\mbox{O}\\
\\
\end{array}$Menentukan mol $\mbox{HC}\ell$ yang bereaksi dengan $\mbox{NH}_{3}$dari reaksi NaOH dengan $\mbox{HC}\ell$sisa.
$\begin{alignedat}{1}\mbox{mol HC}\ell_{\mbox{awal}} & =M\times V\\
& =0,2\times0,025\mbox{ mol}\\
& =0,005\mbox{ mol}
\end{alignedat}
$$\begin{array}{cc}
& \mbox{NH}_{3}\\
\mbox{awal} & 0,002\mbox{ mol}\\
\mbox{reaksi} & 0,002\mbox{ mol}\\
\mbox{setelah reaksi}
\end{array}$ $\begin{array}{cc}
+ & \mbox{HC}\ell\\
& 0,005\mbox{ mol}\\
& 0,002\mbox{ mol}\\
& 0,003\mbox{ mol}
\end{array}$ $\begin{array}{cc}
\rightarrow & \mbox{NH}_{4}\mbox{C}\ell\\
\\
& 0,002\mbox{ mol}\\
& 0,002\mbox{ mol}
\end{array}$Menentukan jumlah mol $\left(\mbox{NH}_{4}\right)_{2}\mbox{SO}_{4}$ dalam 20 mL larutan
$\begin{array}{c}
\left(\mbox{NH}_{4}\right)_{2}\mbox{SO}_{4}\\
\frac{1}{2}\times0,002\mbox{ mol}\\
=0,001\mbox{ mol}
\end{array}$ $\begin{array}{cc}
+ & \mbox{KOH}\\
\\
\\
\end{array}$ $\begin{array}{cc}
\rightarrow & \mbox{K}_{2}\mbox{SO}_{4}\\
\\
\\
\end{array}$ $\begin{array}{cc}
+ & \mbox{2H}_{2}\mbox{O}\\
\\
\\
\end{array}$ $\begin{array}{cc}
+ & \mbox{2NH}_{3}\\
& 0,002\mbox{ mol}\\
\\
\end{array}$Menentukan jumlah mol $\left(\mbox{NH}_{4}\right)_{2}\mbox{SO}_{4}$ dalam 500 mL,
$\begin{aligned}\mbox{mol}\left(\mbox{NH}_{4}\right)_{2}\mbox{SO}_{4} & =\frac{500}{20}\times0,001\mbox{ mol}\\
& =0,025\mbox{ mol}\\
\mbox{massa}\left(\mbox{NH}_{4}\right)_{2}\mbox{SO}_{4} & =n\times M_{r}\\
& =0,025\times132\mbox{ gram}\\
& =3,3\mbox{ gram}\\
\%\left(\mbox{NH}_{4}\right)_{2}\mbox{SO}_{4} & =\frac{3,3}{5}\times100\%\\
& =66\%.
\end{aligned}
$ -
Pertanyaan ke 3 dari 5
3. Pertanyaan
Untuk menentukan konsentrasi dari suatu sampel larutan asam klorida, seorang siswa mengambil 25 mL sampel tersebut kemudian dilarutkan ke dalam air hingga volume larutan tepat 250 mL. Dia membuat larutan standar untuk titrasi, dengan melarutkan 3,78 gram $\mbox{NaHCO}_{3}$ ke dalam air sehingga volume larutan menjadi 250 mL. 25 mL larutan $\mbox{NaHCO}_{3}$ tersebut tepat bereaksi dengan 30 mL larutan asam klorida. Tentukan konsentrasi asam klorida mula-mula.
BetulMenghitung mol $\mbox{NaHCO}_{3}$ dalam 250 mL.
$\begin{alignedat}{1}n & =\frac{m}{M_{r}}\\
& =\frac{3,78}{84}\mbox{ mol}\\
& =0,045\mbox{ mol}
\end{alignedat}
$Sehingga, mol $\mbox{NaHCO}_{3}$ dalam 25 mL, yang merupakan jumlah mol reaksi dengan asam klorida:
$\begin{alignedat}{1}n & =\frac{25\mbox{ mL}}{250\mbox{ mL}}\times0,045\mbox{ mol}\\
& =0,0045\mbox{ mol}
\end{alignedat}
$Menghitung mol asam klorida (volume 30 mL) yang bereaksi dengan $\mbox{NaHCO}_{3}$
$\begin{array}{c}
\mbox{NaHCO}_{3}\\
0,0045\mbox{ mol}
\end{array}$$\begin{array}{cc}
+ & \mbox{HC}\ell\\
& 0,0045\mbox{ mol}
\end{array}$$\begin{array}{cc}
\rightarrow & \mbox{NaC}\ell+\mbox{CO}_{2}+\mbox{H}_{2}\mbox{O}\\
\\
\end{array}$Menghitung mol $\mbox{HC}\ell$ dalam 250 mL.
$\begin{alignedat}{1}n & =\frac{250\mbox{ mL}}{30\mbox{ mL}}\times0,0045\mbox{ mol}\\
& =0,0375\mbox{ mol}
\end{alignedat}
$Mol $\mbox{HC}\ell$ dalam 250 mL sama dengan mol $\mbox{HC}\ell$ dalam 25 mL karena proses pengenceran tidak merubah jumlah mol dalam larutan, sehingga konsentrasi $\mbox{HC}\ell$ dalam 25 mL:
$\begin{alignedat}{1}M & =\frac{n}{V}\\
& =\frac{0,0375}{0,25}\mbox{ M}\\
& =1,5\mbox{ M.}
\end{alignedat}
$SalahMenghitung mol $\mbox{NaHCO}_{3}$ dalam 250 mL.
$\begin{alignedat}{1}n & =\frac{m}{M_{r}}\\
& =\frac{3,78}{84}\mbox{ mol}\\
& =0,045\mbox{ mol}
\end{alignedat}
$Sehingga, mol $\mbox{NaHCO}_{3}$ dalam 25 mL, yang merupakan jumlah mol reaksi dengan asam klorida:
$\begin{alignedat}{1}n & =\frac{25\mbox{ mL}}{250\mbox{ mL}}\times0,045\mbox{ mol}\\
& =0,0045\mbox{ mol}
\end{alignedat}
$Menghitung mol asam klorida (volume 30 mL) yang bereaksi dengan $\mbox{NaHCO}_{3}$
$\begin{array}{c}
\mbox{NaHCO}_{3}\\
0,0045\mbox{ mol}
\end{array}$$\begin{array}{cc}
+ & \mbox{HC}\ell\\
& 0,0045\mbox{ mol}
\end{array}$$\begin{array}{cc}
\rightarrow & \mbox{NaC}\ell+\mbox{CO}_{2}+\mbox{H}_{2}\mbox{O}\\
\\
\end{array}$Menghitung mol $\mbox{HC}\ell$ dalam 250 mL.
$\begin{alignedat}{1}n & =\frac{250\mbox{ mL}}{30\mbox{ mL}}\times0,0045\mbox{ mol}\\
& =0,0375\mbox{ mol}
\end{alignedat}
$Mol $\mbox{HC}\ell$ dalam 250 mL sama dengan mol $\mbox{HC}\ell$ dalam 25 mL karena proses pengenceran tidak merubah jumlah mol dalam larutan, sehingga konsentrasi $\mbox{HC}\ell$ dalam 25 mL:
$\begin{alignedat}{1}M & =\frac{n}{V}\\
& =\frac{0,0375}{0,25}\mbox{ M}\\
& =1,5\mbox{ M.}
\end{alignedat}
$ -
Pertanyaan ke 4 dari 5
4. Pertanyaan
Sebanyak 0,5 gram sampel mengandung logam nikel ($A_{r}$=59) direaksikan dengan 50 mL larutan $\mbox{H}_{2}\mbox{SO}_{4}$0,5 M (berlebih).
$\mbox{Ni}+\mbox{H}_{2}\mbox{SO}_{4}\rightarrow\mbox{NiSO}_{4}+\mbox{H}_{2}$
Setelah reaksi terjadi, ke dalam campuran ditambahkan air murni sehingga volume larutan menjadi 250 mL. 25 mL larutan ini direaksikan dengan larutan NaOH 0,2 M. Dibutuhkan 18 mL larutan NaOH untuk menetralkan $\mbox{H}_{2}\mbox{SO}_{4}$ dalam larutan. Tentukan massa nikel di dalam sampel tersebut.
BetulMenentukan mol reaksi NaOH dengan $\mbox{H}_{2}\mbox{SO}_{4}$(sisa)
$\mbox{2NaOH}+\mbox{H}_{2}\mbox{SO}_{4}\rightarrow\mbox{Na}_{2}\mbox{SO}_{4}+\mbox{H}_{2}\mbox{O}$
$\begin{alignedat}{1}\mbox{mol NaOH} & =0,2\mbox{ M}\times18\mbox{ mL}\\
& =3,6\mbox{ mmol}\\
\mbox{mol}\mbox{H}_{2}\mbox{SO}_{4} & =\frac{1}{2}\times3,6\mbox{ mmol}\\
& =1,8\mbox{ mmol}
\end{alignedat}
$Mol $\mbox{H}_{2}\mbox{SO}_{4}$ dalam 25 mL = 1,8 mmol
$\begin{alignedat}{1}\mbox{mol}\mbox{H}_{2}\mbox{SO}_{4}(250\mbox{ mL)} & =\frac{250\mbox{ mL}}{25\mbox{ mL}}\times1,8\mbox{ mmol}\\
& =18\mbox{ mmol}
\end{alignedat}
$Jumlah mol $\mbox{H}_{2}\mbox{SO}_{4}$dalam 250 mL merupakan jumlah $\mbox{H}_{2}\mbox{SO}_{4}$ sisa reaksi, selanjutnya menghitung mol $\mbox{H}_{2}\mbox{SO}_{4}$ reaksi:
$\begin{alignedat}{1}\mbox{mol}\mbox{H}_{2}\mbox{SO}_{4}\mbox{awal} & =0,5\mbox{ M}\times50\mbox{ mL}\\
& =25\mbox{ mmol}\\
\mbox{mol}\mbox{H}_{2}\mbox{SO}_{4}\mbox{reaksi} & =25\mbox{ mmol}-18\mbox{ mmol}\\
& =7\mbox{ mmol}
\end{alignedat}
$$\begin{array}{c}
\mbox{Ni}\\
7\mbox{ mmol}
\end{array}$$\begin{array}{cc}
+ & \mbox{H}_{2}\mbox{SO}_{4}\\
& 7\mbox{ mmol}
\end{array}$$\begin{array}{cc}
\rightarrow & \mbox{NiSO}_{4}\\
\\
\end{array}$$\begin{array}{cc}
+ & \mbox{H}_{2}\\
\\
\end{array}$$\begin{alignedat}{1}\mbox{mol Ni} & =7\mbox{ mmol}\\
& =0,007\mbox{ mol}\\
\mbox{massa Ni} & =n\times M_{r}\\
& =0,007\times59\mbox{ gram}\\
& =0,413\mbox{ gram}.
\end{alignedat}
$SalahMenentukan mol reaksi NaOH dengan $\mbox{H}_{2}\mbox{SO}_{4}$(sisa)
$\mbox{2NaOH}+\mbox{H}_{2}\mbox{SO}_{4}\rightarrow\mbox{Na}_{2}\mbox{SO}_{4}+\mbox{H}_{2}\mbox{O}$
$\begin{alignedat}{1}\mbox{mol NaOH} & =0,2\mbox{ M}\times18\mbox{ mL}\\
& =3,6\mbox{ mmol}\\
\mbox{mol}\mbox{H}_{2}\mbox{SO}_{4} & =\frac{1}{2}\times3,6\mbox{ mmol}\\
& =1,8\mbox{ mmol}
\end{alignedat}
$Mol $\mbox{H}_{2}\mbox{SO}_{4}$ dalam 25 mL = 1,8 mmol
$\begin{alignedat}{1}\mbox{mol}\mbox{H}_{2}\mbox{SO}_{4}(250\mbox{ mL)} & =\frac{250\mbox{ mL}}{25\mbox{ mL}}\times1,8\mbox{ mmol}\\
& =18\mbox{ mmol}
\end{alignedat}
$Jumlah mol $\mbox{H}_{2}\mbox{SO}_{4}$dalam 250 mL merupakan jumlah $\mbox{H}_{2}\mbox{SO}_{4}$ sisa reaksi, selanjutnya menghitung mol $\mbox{H}_{2}\mbox{SO}_{4}$ reaksi:
$\begin{alignedat}{1}\mbox{mol}\mbox{H}_{2}\mbox{SO}_{4}\mbox{awal} & =0,5\mbox{ M}\times50\mbox{ mL}\\
& =25\mbox{ mmol}\\
\mbox{mol}\mbox{H}_{2}\mbox{SO}_{4}\mbox{reaksi} & =25\mbox{ mmol}-18\mbox{ mmol}\\
& =7\mbox{ mmol}
\end{alignedat}
$$\begin{array}{c}
\mbox{Ni}\\
7\mbox{ mmol}
\end{array}$$\begin{array}{cc}
+ & \mbox{H}_{2}\mbox{SO}_{4}\\
& 7\mbox{ mmol}
\end{array}$$\begin{array}{cc}
\rightarrow & \mbox{NiSO}_{4}\\
\\
\end{array}$$\begin{array}{cc}
+ & \mbox{H}_{2}\\
\\
\end{array}$$\begin{alignedat}{1}\mbox{mol Ni} & =7\mbox{ mmol}\\
& =0,007\mbox{ mol}\\
\mbox{massa Ni} & =n\times M_{r}\\
& =0,007\times59\mbox{ gram}\\
& =0,413\mbox{ gram}.
\end{alignedat}
$ -
Pertanyaan ke 5 dari 5
5. Pertanyaan
25 mL larutan mengandung NaOH dan $\mbox{Na}_{2}\mbox{CO}_{3}$ dibutuhkan 25 mL larutan $\mbox{HC}\ell$ 0,1 M hingga terjadi perubahan warna dengan menggunakan indikator fenolftalein (PP) serta penambahan $\mbox{HC}\ell$ 5 mL lagi pada saat ditambahkan indikator metil jingga. Berapakah konsentrasi NaOH dalam larutan sampuran tersebut.
BetulIndikator PP berubah warna pada saat pH larutan sekitar 8,3. Hal ini terjadi ketika semua NaOH dinetralkan, karena NaOH merupakan basa kuat.
$\mbox{NaOH+HC}\ell$$\rightarrow\mbox{NaC}\ell+\mbox{H}_{2}\mbox{O}$
Untuk $\mbox{Na}_{2}\mbox{CO}_{3}$ mengalami 2 tahap reaksi.
I: $\mbox{Na}_{2}\mbox{CO}_{3}\mbox{+HC}\ell$$\rightarrow\mbox{NaC}\ell+\mbox{NaHCO}_{3}$
II: $\mbox{NaHCO}_{3}\mbox{+HC}\ell$$\rightarrow\mbox{NaC}\ell+\mbox{H}_{2}\mbox{O}+\mbox{CO}_{2}$
Reaksi $\mbox{HC}\ell$ dengan NaOH dan $\mbox{Na}_{2}\mbox{CO}_{3}$ dibutuhkan 25 mL $\mbox{HC}\ell$.
Reaksi $\mbox{HC}\ell$ dengan $\mbox{NaHCO}_{3}$ dibutuhkan 5 mL.
Karena reaksi I dan II menunjukkan reaksi 2 tahap dari $\mbox{Na}_{2}\mbox{CO}_{3}$ dengan $\mbox{HC}\ell$, maka jumlah volume $\mbox{HC}\ell$ yang dibutuhkan pada reaksi I dan II adalah sama yaitu 5 mL.
Sehingga untuk bereaksi dengan NaOH, dibutuhkan 20 mL (25 mL-5 mL) larutan $\mbox{HC}\ell$.
Selanjutnya, menghitung mol NaOH dari reaksi:
$\begin{alignedat}{1}\mbox{mol HC}\ell & =20\times0,1\mbox{ mmol}\\
& =2\mbox{ mmol}
\end{alignedat}
$$\mbox{HC}\ell\mbox{+NaOH}$$\rightarrow\mbox{NaC}\ell+\mbox{H}_{2}\mbox{O}$
$\begin{alignedat}{1}\mbox{mol NaOH} & =\mbox{mol HC}\ell\\
& =2\mbox{ mmol}\\
\left[\mbox{NaOH}\right] & =\frac{n}{V}\\
& =\frac{2\mbox{ mmol}}{25\mbox{ mL}}\\
& =0,08\mbox{ M}.
\end{alignedat}
$SalahIndikator PP berubah warna pada saat pH larutan sekitar 8,3. Hal ini terjadi ketika semua NaOH dinetralkan, karena NaOH merupakan basa kuat.
$\mbox{NaOH+HC}\ell$$\rightarrow\mbox{NaC}\ell+\mbox{H}_{2}\mbox{O}$
Untuk $\mbox{Na}_{2}\mbox{CO}_{3}$ mengalami 2 tahap reaksi.
I: $\mbox{Na}_{2}\mbox{CO}_{3}\mbox{+HC}\ell$$\rightarrow\mbox{NaC}\ell+\mbox{NaHCO}_{3}$
II: $\mbox{NaHCO}_{3}\mbox{+HC}\ell$$\rightarrow\mbox{NaC}\ell+\mbox{H}_{2}\mbox{O}+\mbox{CO}_{2}$
Reaksi $\mbox{HC}\ell$ dengan NaOH dan $\mbox{Na}_{2}\mbox{CO}_{3}$ dibutuhkan 25 mL $\mbox{HC}\ell$.
Reaksi $\mbox{HC}\ell$ dengan $\mbox{NaHCO}_{3}$ dibutuhkan 5 mL.
Karena reaksi I dan II menunjukkan reaksi 2 tahap dari $\mbox{Na}_{2}\mbox{CO}_{3}$ dengan $\mbox{HC}\ell$, maka jumlah volume $\mbox{HC}\ell$ yang dibutuhkan pada reaksi I dan II adalah sama yaitu 5 mL.
Sehingga untuk bereaksi dengan NaOH, dibutuhkan 20 mL (25 mL-5 mL) larutan $\mbox{HC}\ell$.
Selanjutnya, menghitung mol NaOH dari reaksi:
$\begin{alignedat}{1}\mbox{mol HC}\ell & =20\times0,1\mbox{ mmol}\\
& =2\mbox{ mmol}
\end{alignedat}
$$\mbox{HC}\ell\mbox{+NaOH}$$\rightarrow\mbox{NaC}\ell+\mbox{H}_{2}\mbox{O}$
$\begin{alignedat}{1}\mbox{mol NaOH} & =\mbox{mol HC}\ell\\
& =2\mbox{ mmol}\\
\left[\mbox{NaOH}\right] & =\frac{n}{V}\\
& =\frac{2\mbox{ mmol}}{25\mbox{ mL}}\\
& =0,08\mbox{ M}.
\end{alignedat}
$