Kalau kamu tertarik untuk mempelajari tentang Redoks (Reduksi & Oksidasi), simak pembahasannya di sini. Kami juga telah menyiapkan kuis berupa latihan soal dengan tingkatan yang berbeda-beda agar kamu bisa mempraktikkan materi yang telah dipelajari.
Lewat pembahasan ini, kamu bisa belajar mengenai Redoks (Reduksi & Oksidasi). Kamu akan diajak untuk memahami materi dan tentang metode menyelesaikan soal.
Kamu juga akan memperoleh latihan soal interaktif yang tersedia dalam tiga tingkat kesulitan, yaitu mudah, sedang, dan sukar. Tertarik untuk mempelajarinya?
Sekarang, kamu bisa mulai mempelajari materi lewat uraian berikut. Apabila materi ini berguna, bagikan ke teman-teman kamu supaya mereka juga mendapatkan manfaatnya.
Kamu dapat download modul & contoh soal serta kumpulan latihan soal Reduksi dan Oksidasi (Redoks) dalam bentuk pdf pada link dibawah ini:
Definisi
Pengertian konsep redoks adalah ide atau pengertian yang diabstrakkan dari peristiwa konkret mengenai reaksi kimia yang melibatkan berubahnya bilangan oksidasi atom-atom yang terlibat di dalamnya.
Pengertian penyetaraan reaksi redoks (redoks reaction) adalah proses atau cara perbuatan menyeimbangkan atom dan muatan pada ruas kiri dan kanan suatu reaksi redoks.
Pengertian pengolahan limbah adalah proses penghilangan kontaminan dari air limbah industri dan limbah rumah tangga, untuk menghindari polusi pada lingkungan.
Konsep Redoks
Ada beberapa definisi reaksi redoks (reaksi oksidasi dan reduksi) beserta contoh reaksi oksidasi dan reduksi, sebagai berikut
1. Berdasarkan penangkapan atau pelepasan oksigen
- Oksidasi: reaksi yang melibatkan penangkapan atom oksigen.
Contoh: $\mbox{C}+\mbox{O}_{2}\rightarrow\mbox{CO}{}_{2}$
Atom C (karbon) mengalami oksidasi karena dalam reaksi atom karbon mengikat atom oksigen menjadi $\mbox{CO}{}_{2}$. - Reduksi: reaksi yang melibatkan pelepasan atom oksigen.
Contoh: $\mbox{H}_{2}\mbox{O}_{2}\rightarrow\mbox{H}_{2}\mbox{O}+\mbox{O}_{2}$
Senyawa $\mbox{H}_{2}\mbox{O}_{2}$ mengalami reduksi karena dalam reaksi terjadi pelepasan atom oksigen menjadi $\mbox{H}_{2}\mbox{O}$.
2. Berdasarkan pelepasan dan penangkapan elektron
- Oksidasi: reaksi yang melibatkan pelepasan elektron.
Contoh: $\mbox{Na}\rightarrow\mbox{Na}{}^{+}+e$
Untuk membentuk $\mbox{Na}{}^{+}$, atom Na melepas satu elektron sehingga atom Na dikatakan mengalami reaksi oksidasi. - Reduksi: reaksi yang melibatkan penangkapan elektron.
$\mbox{O}+2e\rightarrow\mbox{O}^{2-}$Untuk membentuk $\mbox{O}^{2-}$, atom O menangkap 2 elektron sehingga atom oksigen dikatakan mengalami reaksi reduksi.
3. Berdasarkan perubahan biloks (bilangan oksidasi)
Bilangan oksidasi adalah suatu bilangan yang menunjukkan ukuran kemampuan suatu atom untuk melepas atau menangkap elektron dalam pembentukan suatu senyawa. Nilai bilangan oksidasi menunjukkan banyaknya elektron yang dilepas atau ditangkap, sehingga bilangan oksidasi dapat bertanda positif maupun negatif.
Aturan menentukan biloks
- Biloks unsur bebas = 0, unsur bebas adalah materi yang tersusun atas atas satu jenis atom.
Contoh: Na, $\mbox{N}_{2}$, $\mbox{S}_{8}$, Ar dan lain-lain - Dalam senyawanya, biloks logam golongan IA = +1, golongan IIA = +2, golongan IIIA = +3.
Contoh: biloks Na dalam NaOH
adalah +1 ( karena Na terletak pada golongan IA) - Biloks golongan VII A (untuk senyawa biner) = -1. ( Senyawa biner adalah senyawa yang penyusunnya terdiri atas dua unsur).
Contoh: $\mbox{CaCl}{}_{2}$, biloks Cl dalam $\mbox{CaCl}{}_{2}$ adalah -1. - Biloks atom H = +1, kecuali dalam bentuk hidrida = -1
Contoh: biloks H dalam $\mbox{H}_{2}\mbox{O}$ adalah +1, biloks H dalam NaH adalah -1. - Biloks atom O = -2, kecuali peroksida (= -1), superoksida (=$-\frac{1}{2})$
Contoh: Biloks atom O pada $\mbox{P}_{2}\mbox{O}_{5}$ adalah -2, biloks O pada $\mbox{H}_{2}\mbox{O}_{2}$adalah -1. - Biloks ion tunggal = muatannya.Contoh: biloks Na dalam $\mbox{Na}{}^{+}$adalah +1, biloks Cu dalam $\mbox{Cu}{}^{2+}$adalah +2
- Jumlah biloks
- pada senyawa = 0
Contoh: jumlah biloks atom-atom penyusun $\mbox{H}_{2}\mbox{O}$ adalah 0 - pada ion poliatomik = muatan ionnya.
Contoh: jumlah biloks atom-atom penyusun $\mbox{SO}{}_{4}^{2-}$ adalah -2 (muatan ion = -2)
- pada senyawa = 0
Sehingga definisi redoks berkaitan dengan perubahan biloks adalah: Oksidasi merupakan reaksi yang melibatkan kenaikan biloks dan reduksi adalah reaksi yang melibatkan penurunan biloks.

Oksidator & Reduktor
Dalam reaksi redoks terdapat istilah oksidator dan reduktor.
Oksidator adalah zat yang menyebabkan zat lain mengalam reaksi oksidasi sedangkan dirinya sendiri mengalami reaksi reduksi. Sedangkan reduktor adalah zat yang menyebabkan zat lain mengalam reaksi reduksi sedangkan dirinya sendiri mengalami reaksi oksidasi.

Pada reaksi di atas, atom Ca mengalami oksidasi atau mereduksi oksigen sehingga Ca merupakan reduktor. Sedangkan $\mbox{O}_{2}$ merupakan oksidator karena menyebabkan Ca teroksidasi atau $\mbox{O}_{2}$ sendiri mengalami reduksi.
Autoredoks & Anti Autoredoks
Reaksi autoredoks (disproporsionasi) dan anti autoredoks (konproporsionasi).
- Reaksi autoredoks: reaksi redoks dimana atom yang sama mengalami reaksi oksidasi dan reduksi sekaligus.
Contoh

- Reaksi anti autoredoks: reaksi redoks dimana zat yang sama merupakan hasil oksidasi dan reduksi sekaligus.
Contoh

Penyetaraan Reaksi Redoks
Pada penyetaraan reaksi redoks menggunakan asas:
- Jumlah atom reaktan = jumlah atom produk
- muatan kiri = muatan kanan
Ada dua metode penyetaraan reaksi redoks, yaitu:
- Cara perubahan bilangan oksidasi (PBO)
- Hitung biloks masing-masing unsur
- Setarakan jumlah atom yang mengalami perubahan biloks
- Setarakan jumlah elektron oksidasi dan reduksi
- Kalikan koefisien reaktan dan produk dengan angka pengali dalam penyetaraan elektron oksidasi dan reduksi
- Setarakan muatan reaktan dan produk dengan menambahkan ion $H^{+}$ jika suasana reaksi asam dan menambahkan ion $\mbox{OH}{}^{-}$ jika reaksi berlangsung dalam suasana basa.
- Setarakan jumlah atom hidrogen dengan menambahkan $\mbox{H}_{2}\mbox{O}$
- Cara ion elektron atau setengah reaksi
- Tentukan biloks masing-masing unsur
- Tuliskan setengah reaksi oksidasi dan reduksi
- Setarakan jumlah atom yang mengalami perubahan biloks
- Menuliskan jumlah elektron yang terlibat reaksi pada oksidasi dan reduksi
- Setarakan muatan reaktan dan produk dengan menambahkan ion $\mbox{H}^{+}$ jika suasana reaksi asam dan menambahkan ion $\mbox{OH}{}^{-}$jika reaksi berlangsung dalam suasana basa.
- Setarakan jumlah atom hidrogen dengan menambahkan $\mbox{H}_{2}\mbox{O}$
Pengolahan Limbah
Pengolahan limbah dalam bahasan ini yang dalam prosesnya melibatkan reaksi redoks.
Berbagai macam limbah dapat kita jumpai dalam air limbah seperti bahan organik, minyak, pestisida, dan sebagainya. Oleh karena itu, air buangan harus diproses terlebih dahulu untuk mengurangi zat-zat yang berbahaya untuk lingkungan atau bisa jadi hasil pengolahan tersebut dimungkinkan dapat digunakan kembali.
Kualitas Air
Kualitas air dapat dilihat dari
- pH. Dengan nilai pH dapat menentukan keasaman air, pH < 7 menunjukkan air bersifat asam, pH > 7 menunjukkan air bersifat basa dan pH=7. Tumbuhan dan hewan air hanya hidup pada pH netral. Adanya limbah dapat menaik-turunkan pH air yang nantinya mempengaruhi keberlangsungan makhluk hidup di ekosistem air.
- Tingkat kekeruhan air. Makhluk hidup yang berada di air pastinya membutuhkan sinar matahari. Dengan keruhnya air dapat mengganggu kehidupan tumbuhan dan hewan air karena intensitas cahaya dalam air berkurang.
- Kadar oksigen terlarut (DO). Oksigen dibutuhkan bagi makhluk hidup air. Adanya limbah/zat pencemar akan mengurangi jumlah oksigen yang terlarut. Sehingga jumlah makhluk hidup dengan kondisi tersebut semakin berkurang.
- BOD (biological oxygen demand). BOD menyatakan jumlah oksigen yang digunakan oelh bakteri aerob untuk menguraikan sampah organik. Semakin besar kadar BOD dalam air, semakin banyak sampah organik yang terdapat dalam air, sehingga kualitas air pun berkurang.
- Suhu. Suhu air akan mempengaruhi jumlah oksigen yang terlarut di dalamnya. Semakin tinggi suhu, semakin kecil jumlah oksigen yang terlarut di air sehingga dapat mempengaruhi kehidupan yang ada di dalamnya (hewan dan tumbuhan).
- Kadar zat padat yang terlarut. Zat padat yang terlarut dalam air dapat berupa zat anorganik yang mempengaruhi kesadahan air.
Tujuan Pengelolaan Limbah
Pengolahan air limbah dapat dilakukan dengan memanfaatkan lumpur aktif yang melibatkan reaksi redoks. Pengolahan limbah bertujuan untuk:
- mengurangi bahan kimia berbahaya
- menurunkan BOD
- menghilangkan bau tidak sedap
- menghilangkan senyawa yang dapat diuraikan oleh bakteri secara biologis.
Lumpur Aktif
Lumpur aktif yang digunakan untuk proses pengolahan limbah, mengandung banyak bakteri aerob yang dapat menguraikan limbah organik sehingga mengalami biodegradasi.
Lumpur ini disebut lumpur aktif karena pada saat pengolahan limbah, lumpur ini selalu bergerak naik turun agar terjadi kontak antara limbah, oksigen dan bakteri. Lumpur secara aktif mereduksi substrat yang terkandung di dalam air limbah.
Reaksi: organik+$\mbox{O}_{2}\rightarrow\mbox{CO}{}_{2}+\mbox{H}_{2}\mbox{O}+\mbox{energi}$
Proses Pengolahan Air Limbah
Prinsip proses pengolahan air limbah terdiri atas:
- Proses penanganan primer: tahap pengolahan fisik, yaitu pemisahan padatan yang terdapat dalam air. Pengolahan ini meliputi penyaringan, pengendapan dan tahap pemisahan endapan.
- Proses penanganan sekunder: untuk menghilangkan BOD dan padatan yang tersuspensi dengan reaksi oksidasi.
- Proses penanganan tersier: menghilangkan komponen organik dan anorganik terlarut.
Diagram Pengolahan Limbah dengan Lumpur Aktif
Pengolahan dengan lumpur aktif merupakan tahap pengolahan sekunder. Berikut diagram pengolahan cara lumpur aktif:

Bakteri aerob mengubah sampah organik ( zat-zat yang mengandung C, N atau P) dalam air buangan hasil pengolahan pada tahap primer menjadi biomassa dan gas $\mbox{CO}{}_{2}$. Sementara itu nitrogen organik diubah menjadi amonium dan nitrat, serta fosforus organik menjadi fosfat.
Proses yang terjadi di dalam tangki aerasi sebagai berikut:
$\mbox{(CH}{}_{2}\mbox{O)}+\mbox{O}_{2}(g)\rightarrow\mbox{CO}{}_{2}(g)+\mbox{H}_{2}\mbox{O}(\ell)+\mbox{biomassa}$
$\mbox{N organik}\rightarrow\mbox{NH}{}_{4}^{+}(aq)+\mbox{NO}{}_{3}^{-}(aq)$
$\mbox{P organik}\rightarrow\mbox{H}_{2}\mbox{PO}{}_{4}^{-}(aq)+\mbox{HPO}{}_{3}^{2-}(aq)$
Biomassa hasil degradasi akan tetap berada dalam tangki aerasi sampai air buangan keluar tangki aerasi menuju tangki sendimentasi di mana biomassa mengalami flokulasi ( penggumpalan) membentuk padatan yang mudah mengendap.
Dari tangki sendimentasi (pengendapan), sebagian lumpur dibuang, antara bakteri dalam konsentrasi tinggi dan lapar yang terdapat dalam lumpur aktif dengan jumlah nutrien yang banyak dalam air limbah, memungkinkan penguraian dapat berlangsung dengan cepat (hanya memerlukan waktu beberapa jam saja).
Dengan menggunakan oksigen murni sebagai pengganti udara, maka lebih banyak bakteri yang dapat tumbuh di dalam tangki aerasi, sehingga dapat meningkatkan efisiensi proses sebesar 5-10% dari proses biasa.
Contoh Soal dan Pembahasan
- Tuliskan setengah reaksi dari reaksi redoks berikut dan tentukan oksidator dan reduktor.$\mbox{3Mg}(s)+\mbox{N}_{2}(g)\rightarrow\mbox{Mg}{}_{3}\mbox{N}_{2}(s)$
Jawaban- Menentukan biloks masing-masing unsur:
- Reaktan: Mg = 0 (unsur bebas), N dalam $\mbox{N}_{2}$adalah 0 (unsur bebas)
- Produk: Mg = +2 (golongan IIA), N dalam $\mbox{Mg}{}_{3}\mbox{N}_{2}$ adalah -3.
- Setengah reaksi oksidasi: $\mbox{Mg}\rightarrow\mbox{Mg}{}^{2+}+2e$
- Setengah reaksi reduksi: $\mbox{N}_{2}+6e\rightarrow2\mbox{N}^{3-}$
- Oksidator : $\mbox{N}_{2}$(mengalami reduksi / menyebabkan Mg teroksidasi)
- Reduktor: Mg ( mengalami oksidasi / menyebabkan $\mbox{N}_{2}$ reduksi)
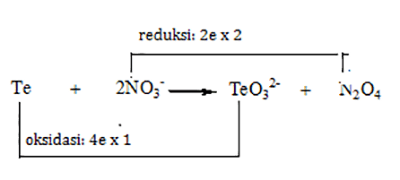
- Setarakan reaksi berikut ini dengan cara PBO dalam kondisi asam :$\mbox{Te}+\mbox{NO}{}_{3}^{-}\rightarrow\mbox{TeO}{}_{3}^{2-}+\mbox{N}_{2}\mbox{O}_{4}$
Jawaban- Menentukan biloks masing-masing unsur

- Setarakan jumlah atom yang mengalami perubahan biloks
$\mbox{Te}+\mbox{2NO}{}_{3}^{-}\rightarrow\mbox{TeO}{}_{3}^{2-}+\mbox{N}_{2}\mbox{O}_{4}$ - Setarakan jumlah elektron oksidasi dan reduksi

- Kalikan koefisien reaktan dan produk dengan angka pengali dalam penyetaraan elektron oksidasi dan reduksi
$\mbox{Te}+\mbox{4NO}{}_{3}^{-}\rightarrow\mbox{TeO}{}_{3}^{2-}+2\mbox{N}_{2}\mbox{O}_{4}$ - Setarakan muatan reaktan dan produk dengan menambahkan ion $\mbox{H}^{+}$ karena suasana reaksi asam.$\mbox{Te}+\mbox{4NO}{}_{3}^{-}+2\mbox{H}^{+}\rightarrow\mbox{TeO}{}_{3}^{2-}+2\mbox{N}_{2}\mbox{O}_{4}$,
muatan di ruas kiri adalah -4, muatan di ruas kanan adalah -2, agar muatan setara di ruas kiri ditambahkan 2$\mbox{H}^{+}$ - Setarakan jumlah atom hidrogen dengan menambahkan $\mbox{H}_{2}\mbox{O}$$\mbox{Te}+\mbox{4NO}{}_{3}^{-}+2\mbox{H}^{+}\rightarrow\mbox{TeO}{}_{3}^{2-}+2\mbox{N}_{2}\mbox{O}_{4},+\mbox{H}_{2}\mbox{O}$,
untuk menyetarakan jumlah atom H, ditambahkan $\mbox{H}_{2}\mbox{O}$ di ruas kanan agar setara.
- Menentukan biloks masing-masing unsur
-
Setarakan reaksi berikut ini dengan cara ion elektron dalam kondisi asam:
$\mbox{Te}+\mbox{NO}{}_{3}^{-}\rightarrow\mbox{TeO}{}_{3}^{2-}+\mbox{N}_{2}\mbox{O}_{4}$Jawaban
- Menentukan biloks masing-masing unsur

- Menuliskan reaksi oksidasi dan reduksi:
- Reaksi oksidasi: $\mbox{Te}\rightarrow\mbox{TeO}{}_{3}^{2-}$
- Reaksi reduksi: $\mbox{NO}{}_{3}^{-}\rightarrow\mbox{N}_{2}\mbox{O}_{4}$
- Setarakan jumlah atom yang mengalami perubahan biloks
- Reaksi oksidasi: $\mbox{Te}\rightarrow\mbox{TeO}{}_{3}^{2-}$
- Reaksi reduksi: $\mbox{2NO}{}_{3}^{-}\rightarrow\mbox{N}_{2}\mbox{O}_{4}$
- Menuliskan jumlah elektron yang terlibat reaksi pada oksidasi dan reduksi
- Reaksi oksidasi: $\mbox{Te}\rightarrow\mbox{TeO}{}_{3}^{2-}+4e$ (terjadi kenaikan biloks dari 0 menjadi +4)
- Reaksi reduksi: $2\mbox{NO}{}_{3}^{-}\rightarrow\mbox{N}_{2}\mbox{O}_{4}$ (terjadi penurunan biloks dari +10 menjadi +8, ingat dikalikan dua karena ada dua atom N)
- Setarakan muatan reaktan dan produk dengan menambahkan ion $\mbox{H}^{+}$ karena suasana reaksi asam.
- Reaksi oksidasi: $\mbox{Te}\rightarrow\mbox{TeO}{}_{3}^{2-}+4e+6\mbox{H}^{+}$, muatan di ruas kiri adalah 0 (nol), sedangkan di ruas kanan ada -6 ( diperoleh dari -2+-4), ingat elektron bermuatan -1. Sehingga ditambahkan $\mbox{H}^{+}$sejumlah 6 di ruas kanan agar setara ( muatan sama-sama nol di kedua ruas).
- Reaksi reduksi: $2\mbox{NO}{}_{3}^{-}+2e+4\mbox{H}^{+}\rightarrow\mbox{N}_{2}\mbox{O}_{4}$, jumlah muatan di kiri adalah -4 ( diperoleh -2+-(2)), ingat elektron bermuatan -1, sedangkan muatan di ruas kanan adalah nol. Sehingga di ruas kiri ditambahkan $4\mbox{H}^{+}$.
- Setarakan jumlah atom hidrogen dengan menambahkan $\mbox{H}_{2}\mbox{O}$
- Reaksi oksidasi: $\mbox{Te}+3\mbox{H}_{2}\mbox{O}\rightarrow\mbox{TeO}{}_{3}^{2-}+4e+6\mbox{H}^{+}$, untuk menyetarakan jumlah atom H, ditambahkan $3\mbox{H}_{2}\mbox{O}$ di ruas kiri agar setara, sama-sama 6 atom H.
- Reaksi reduksi: $2\mbox{NO}{}_{3}^{-}+2e+4\mbox{H}^{+}\rightarrow\mbox{N}_{2}\mbox{O}_{4}+2\mbox{H}_{2}\mbox{O}$, untuk menyetarakan jumlah atom H, ditambahkan $2\mbox{H}_{2}\mbox{O}$ di ruas kanan agar setara, sama-sama 4 atom H.
- Menentukan biloks masing-masing unsur
- Apakah tujuan penambahan karbon aktif pada pengolahan limbah?
Jawaban
Untuk menyerap zat-zat berbahaya. - Lumpur aktif adalah lumpur yang mengandung banyak bakteri aerob yang dapat menguraikan limbah organik sehingga mengalami biodegradasi. Diantara pilihan di bawah ini mana sajakah yang termasuk limbah organik?
(a) pestisida
(b) deterjen
(c) sisa makanan
(d) kaleng
(e) botol plastik
Jawaban C
Limbah organik adalah limbah yang berasal dari sisa makhluk hidup atau yang berasal dari alam.