Hukum Hess merupakan salah satu materi kimia yang cukup menarik untuk dibahas. Kalau kebetulan kamu ingin belajar tentang materi ini lebih dalam, simak penjelasan lengkapnya berikut. Kami juga telah menyediakan soal latihan yang bisa dikerjakan untuk mengasah kemampuanmu.
Lewat pembahasan ini, kamu bisa belajar mengenai Hukum Hess. Kamu akan diajak untuk memahami materi dan tentang metode menyelesaikan soal.
Kamu juga akan memperoleh latihan soal interaktif yang tersedia dalam tiga tingkat kesulitan, yaitu mudah, sedang, dan sukar. Tertarik untuk mempelajarinya?
Sekarang, kamu bisa mulai mempelajari materi lewat uraian berikut. Apabila materi ini berguna, bagikan ke teman-teman kamu supaya mereka juga mendapatkan manfaatnya.
Kamu dapat download modul & contoh soal serta kumpulan latihan soal dalam bentuk pdf pada link dibawah ini:
Kalor reaksi hanya bergantung pada keadaan awal dan keadaan akhir, tidak pada lintasan atau jalannya reaksi.
Kalor reaksi dapat ditentukan melalui percobaan, yaitu dengan kalorimeter. Meski demikian tidak semua reaksi dapat diukur melalui percobaan.
Henry Hess, seorang ahli kimia dari Russia kelahiran Swiss menemukan cara lain yaitu berdasarkan data termokimia yang ada, melalui sebuah prinsip yang dinamai Hukum Hess dalam kimia.
Hukum ini berkaitan dengan reaksi-reaksi yang dapat dilangsungkan melalui dua atau lebih lintasan. Misalkan reaksi antara karbon grafit dengan oksigen membentuk karbon dioksida. Reaksi dapat berlangsung secara:
- 1 tahap, langsung.
$\mbox{C}+\mbox{O}_{2}\rightarrow\mbox{CO}_{2}$$\Delta H=-394$ kJ - 2 tahap, melalui pembentukan karbon monoksida
$\mbox{C}+\frac{1}{2}\mbox{O}_{2}\rightarrow\mbox{CO}$$\Delta H=-111$ kJ
$\mbox{CO}+\frac{1}{2}\mbox{O}_{2}\rightarrow\mbox{CO}_{2}$$\Delta H=-283$ k.
JBila kedua reaksi ini dijumlahkan, didapat nilai entalpi total yang sama dengan reaksi 1 tahap.
Sehingga berdasarkan data ini, Hess dapat menyatakan bahwa kalor reaksi hanya bergantung pada keadaan awal dan akhirnya, bukan pada lintasan atau jalannya reaksi tersebut, baik melalui 1 tahap atau lebih akan didapat nilai yang sama.
Aplikasi Hukum Hess dapat dinyatakan dalam bentuk diagram siklus yang dapat digambarkan sebagai berikut
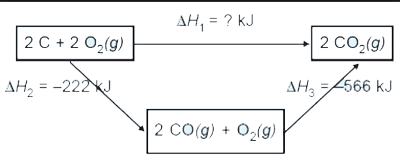
atau dalam bentuk diagram tingkat energi:

Contoh Soal dan Pembahasan
Diketahui data-data entalpi reaksi:
(1) $\mbox{H}_{2}+\mbox{F}_{2}\rightarrow2\mbox{HF}$ $\Delta H=-537$ kJ
(2) $\mbox{C}+2\mbox{F}_{2}\rightarrow\mbox{CF}_{4}$ $\Delta H=-680$ kJ
(3) $2\mbox{C}+2\mbox{H}_{2}\rightarrow\mbox{C}_{2}\mbox{H}_{4}$ $\Delta H=52,3$ kJ
Tentukanlah entalpi reaksi (4) berikut
$\mbox{C}_{2}\mbox{H}_{4}+6\mbox{F}_{2}\rightarrow2\mbox{CF}_{4}+4\mbox{HF}$
Jawaban
Perubahan entalpi reaksi (4) dapat diketahui dengan menyusun reaksi (1), (2), (3) , kemudian dijumlahkan sehingga didapat:

Latihan Soal Hukum Hess (Mudah)
Ringkasan kuis
0 dari 5 pertanyaan telah diselesaikan
Pertanyaan:
- 1
- 2
- 3
- 4
- 5
Informasi
You have already completed the quiz before. Hence you can not start it again.
Quiz is loading...
Anda harus masuk atau mendaftar untuk memulai kuis.
Anda harus menyelesaikan kuis dibawah ini, untuk memulai kuis ini:
Hasil
Hasil
0 dari 5 pertanyaan terjawab dengan benar
Waktu yang telah berlalu
Kategori
- Tidak Berkategori 0%
- 1
- 2
- 3
- 4
- 5
- Terjawab
- Tinjau
-
Pertanyaan ke 1 dari 5
1. Pertanyaan
Hukum Hess menyatakan bahwa … .
BetulHukum Hess menyatakan bahwa suatu reaksi akan memiliki nilai perubahan entalpi sebesar penjumlahan perubahan entalpi dari proses atau reaksi yang lebih kecil di dalam reaksi tersebut.
SalahHukum Hess menyatakan bahwa suatu reaksi akan memiliki nilai perubahan entalpi sebesar penjumlahan perubahan entalpi dari proses atau reaksi yang lebih kecil di dalam reaksi tersebut.
-
Pertanyaan ke 2 dari 5
2. Pertanyaan
Perhatikan gambar berikut:

Berdasarkan diagram di atas, pernyataan berikut yang benar adalah … .
BetulPernyataan yang benar sesuai dengan hukum Hess adalah
$\Delta H_{3}$$=\Delta H_{1}$$+\Delta H_{2}$ atau $\Delta H_{2}$$=\Delta H_{3}$$-\Delta H_{1}$ atau $\Delta H_{1}$$=\Delta H_{3}$$-\Delta H_{2}.$
SalahPernyataan yang benar sesuai dengan hukum Hess adalah
$\Delta H_{3}$$=\Delta H_{1}$$+\Delta H_{2}$ atau $\Delta H_{2}$$=\Delta H_{3}$$-\Delta H_{1}$ atau $\Delta H_{1}$$=\Delta H_{3}$$-\Delta H_{2}.$
-
Pertanyaan ke 3 dari 5
3. Pertanyaan
Diketahui data dari reaksi pembentukan nitrogen monoksida sebagai berikut.
$\mbox{N}_{2}(g)+\mbox{O}_{2}(g)$$\rightarrow2\mbox{NO}(g)$ $\Delta H^{\circ}=+180,50\mbox{ kJ}$
Berapakah besar entalpi pembentukan standar nitrogen monoksida?
BetulEntalpi pembentukan standar didefinisikan sebagai pembentukan satu mol senyawa dari unsur pembentuknya pada keadaan standar, maka kita perlu menyesuaikan bentuk reaksinya menjadi:
$\frac{1}{2}\mbox{N}_{2}(g)+\frac{1}{2}\mbox{O}_{2}(g)$$\rightarrow\mbox{NO}$
Nilai entalpinya pun kita bagi 2, dan didapat:
$\Delta H_{\mbox{f}}^{\circ}\mbox{NO}=90,25$ kJ/mol.
SalahEntalpi pembentukan standar didefinisikan sebagai pembentukan satu mol senyawa dari unsur pembentuknya pada keadaan standar, maka kita perlu menyesuaikan bentuk reaksinya menjadi:
$\frac{1}{2}\mbox{N}_{2}(g)+\frac{1}{2}\mbox{O}_{2}(g)$$\rightarrow\mbox{NO}$
Nilai entalpinya pun kita bagi 2, dan didapat:
$\Delta H_{\mbox{f}}^{\circ}\mbox{NO}=90,25$ kJ/mol.
-
Pertanyaan ke 4 dari 5
4. Pertanyaan
Dari data berikut:
$\mbox{NO}_{2}(g)$$\rightarrow\mbox{NO}(g)+\frac{1}{2}\mbox{O}_{2}(g)$
$\Delta H^{\circ}=57,07\mbox{ kJ}$$\mbox{N}_{2}(g)+\mbox{O}_{2}(g)\rightarrow2\mbox{NO}(g)\Delta H^{\circ}=180,50\mbox{ kJ}$
Berapakah nilai entalpi pembentukan standar nitrogen dioksida?
BetulSesuai hukum Hess:
$\mbox{N}_{2}(g)+\mbox{O}_{2}(g)\rightarrow2\mbox{NO}(g)\,\,\,\,\,\,\,\Delta H=180,50\mbox{ kJ}$
$2\mbox{NO}(g)+\mbox{O}_{2}(g)\rightarrow2\mbox{NO}_{2}(g)\,\,\Delta H=114,14\mbox{ kJ}$
$\underline{\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}}+$
$\mbox{N}_{2}(g)+2\mbox{O}_{2}(g)\rightarrow2\mbox{NO}_{2}\,\,\,\,\,\,\,\,\Delta H=+294,64\mbox{ kJ}$
Maka $\Delta H_{\mbox{f}}^{\circ}=\frac{294,64}{2}$$=+147,32$ kJ/mol.
SalahSesuai hukum Hess:
$\mbox{N}_{2}(g)+\mbox{O}_{2}(g)\rightarrow2\mbox{NO}(g)\,\,\,\,\,\,\,\Delta H=180,50\mbox{ kJ}$
$2\mbox{NO}(g)+\mbox{O}_{2}(g)\rightarrow2\mbox{NO}_{2}(g)\,\,\Delta H=114,14\mbox{ kJ}$
$\underline{\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}}+$
$\mbox{N}_{2}(g)+2\mbox{O}_{2}(g)\rightarrow2\mbox{NO}_{2}\,\,\,\,\,\,\,\,\Delta H=+294,64\mbox{ kJ}$
Maka $\Delta H_{\mbox{f}}^{\circ}=\frac{294,64}{2}$$=+147,32$ kJ/mol.
-
Pertanyaan ke 5 dari 5
5. Pertanyaan
Perhatikan diagram berikut.

Pernyataan yang benar berdasarkan diagram di atas adalah … , kecuali … .
BetulPerubahan entalpi pembakaran standar adalah pembakaran satu mol zat pada keadaan standar. Dari diagram, jumlah zat yang dibakar adalah 2 mol (dilihat dari koefisien reaksinya), maka dapat dituliskan :
$\frac{1}{2}(-b-(-a))=\frac{1}{2}(a-b)$
SalahPerubahan entalpi pembakaran standar adalah pembakaran satu mol zat pada keadaan standar. Dari diagram, jumlah zat yang dibakar adalah 2 mol (dilihat dari koefisien reaksinya), maka dapat dituliskan :
$\frac{1}{2}(-b-(-a))=\frac{1}{2}(a-b)$
Latihan Soal Hukum Hess (Sedang)
Ringkasan kuis
0 dari 5 pertanyaan telah diselesaikan
Pertanyaan:
- 1
- 2
- 3
- 4
- 5
Informasi
You have already completed the quiz before. Hence you can not start it again.
Quiz is loading...
Anda harus masuk atau mendaftar untuk memulai kuis.
Anda harus menyelesaikan kuis dibawah ini, untuk memulai kuis ini:
Hasil
Hasil
0 dari 5 pertanyaan terjawab dengan benar
Waktu yang telah berlalu
Kategori
- Tidak Berkategori 0%
- 1
- 2
- 3
- 4
- 5
- Terjawab
- Tinjau
-
Pertanyaan ke 1 dari 5
1. Pertanyaan
Perhatikan gambar diagram berikut.

Pernyataan berikut yang benar berdasarkan diagram di atas adalah … .
Betul$\begin{alignedat}{1}AD & =AB+BC+CD\\
& =+488+(-1436)+610\\
& =-338\mbox{ kJ/mol.}
\end{alignedat}
$Salah$\begin{alignedat}{1}AD & =AB+BC+CD\\
& =+488+(-1436)+610\\
& =-338\mbox{ kJ/mol.}
\end{alignedat}
$ -
Pertanyaan ke 2 dari 5
2. Pertanyaan
Perhatikan gambar berikut ini.

Nilai $x$ pada diagram di atas adalah … kJ.
Betul$\begin{alignedat}{1}\triangle H_{1} & =\triangle H_{2}+\triangle H_{3}\\
& =-593+-197\mbox{ kJ}\\
& =-790\mbox{ kJ}.
\end{alignedat}
$Salah$\begin{alignedat}{1}\triangle H_{1} & =\triangle H_{2}+\triangle H_{3}\\
& =-593+-197\mbox{ kJ}\\
& =-790\mbox{ kJ}.
\end{alignedat}
$ -
Pertanyaan ke 3 dari 5
3. Pertanyaan
Diketahui data-data berikut untuk reaksi antara unsur fosfor dan klor.
$\begin{array}{ccc}
\mbox{P}_{4}(s) & + & 6\mbox{Cl}_{2}(g)\\
4\mbox{PCl}_{5}(g)
\end{array}$ $\begin{array}{ccc}
\rightarrow & 4\mbox{PCl}_{3}(g) & \Delta H\\
\rightarrow & \mbox{P}_{4}(s)+10\mbox{Cl}_{2}(g) & \Delta H
\end{array}$ $\begin{array}{cc}
= & -2439\mbox{ kJ}\\
= & 3438\mbox{ kJ}
\end{array}$Maka berapakah nilai entalpi reaksi untuk reaksi pembentukan fosfor pentaklorida dari fosfor triklorida dan klorin ?
BetulSesuai hukum Hess:
$4\mbox{PCl}_{3}(g)\rightarrow\mbox{P}_{4}(s)+6\mbox{Cl}_{2}(g)\Delta H=2439\mbox{ kJ}$
$\underline{\mbox{P}_{4}(s)+10\mbox{Cl}_{2}(g)\rightarrow4\mbox{PCl}_{5}(g)\,\Delta H=-3438\mbox{ kJ}}$
$4\mbox{PCl}_{3}(g)+4\mbox{Cl}_{2}(g)\rightarrow4\mbox{PCl}_{5}\,\Delta H=-999\mbox{ kJ}$
Dibagi 4 untuk menyederhanakan reaksi, demikian pula nilai perubahan entalpi dibagi 4, maka didapat:
$\mbox{PCl}_{3}(g)+\mbox{Cl}_{2}(g)$$\rightarrow\mbox{PCl}_{5}\,\Delta H=-249,8\mbox{ kJ}.$
SalahSesuai hukum Hess:
$4\mbox{PCl}_{3}(g)\rightarrow\mbox{P}_{4}(s)+6\mbox{Cl}_{2}(g)\Delta H=2439\mbox{ kJ}$
$\underline{\mbox{P}_{4}(s)+10\mbox{Cl}_{2}(g)\rightarrow4\mbox{PCl}_{5}(g)\,\Delta H=-3438\mbox{ kJ}}$
$4\mbox{PCl}_{3}(g)+4\mbox{Cl}_{2}(g)\rightarrow4\mbox{PCl}_{5}\,\Delta H=-999\mbox{ kJ}$
Dibagi 4 untuk menyederhanakan reaksi, demikian pula nilai perubahan entalpi dibagi 4, maka didapat:
$\mbox{PCl}_{3}(g)+\mbox{Cl}_{2}(g)$$\rightarrow\mbox{PCl}_{5}\,\Delta H=-249,8\mbox{ kJ}.$
-
Pertanyaan ke 4 dari 5
4. Pertanyaan
Seorang ilmuwan menemukan nilai entalpi reaksi berikut menggunakan kalorimeter.
$\begin{array}{ccc}
\mbox{H}_{2}\mbox{S}(g) & + & 2\mbox{O}_{2}(g)\\
\mbox{H}_{2}\mbox{S}(g) & + & 2\mbox{O}_{2}(g)\\
\mbox{H}_{2}\mbox{O}(l)
\end{array}$$\begin{array}{cc}
\rightarrow & \mbox{H}_{2}\mbox{SO}_{4}(l)\\
\rightarrow & \mbox{SO}_{3}(g)\\
\rightarrow & \mbox{H}_{2}\mbox{O}(g)
\end{array}$$\begin{array}{cc}
\\
+ & \mbox{H}_{2}\mbox{O}(l)\\
\\
\end{array}$$\begin{array}{ccc}
\Delta H & = & -235,5\mbox{ kJ}\\
\Delta H & = & -207\mbox{ kJ}\\
\Delta H & = & 44\mbox{ kJ}
\end{array}$Berapakah besar entalpi pembentukan asam sulfat dari reaksi antara gas sulfur trioksida dengan uap air?
BetulSesuai hukum Hess:
$\mbox{H}_{2}\mbox{S}(g)+2\mbox{O}_{2}(g)$$\rightarrow\mbox{H}_{2}\mbox{SO}_{4}(l)\,\,\,\,\,\,\,\,\,\Delta H$$=-235,5\mbox{ kJ}$
$\mbox{SO}_{3}(g)+\mbox{H}_{2}\mbox{O}(l)$$\rightarrow\mbox{H}_{2}\mbox{S}(g)+2\mbox{O}_{2}(g)\Delta H$$=207,7\mbox{ kJ}$
$\underline{\mbox{H}_{2}\mbox{O}(g)\rightarrow\mbox{H}_{2}\mbox{O}(l)}$
$\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\Delta H=-44\mbox{ kJ}$$\mbox{SO}_{3}(g)+\mbox{H}_{2}\mbox{O}(g)$$\rightarrow\mbox{H}_{2}\mbox{SO}_{4}(l)$$\,\,\,\,\,\,\,\,\,\Delta H=-71,8\mbox{ kJ}$
SalahSesuai hukum Hess:
$\mbox{H}_{2}\mbox{S}(g)+2\mbox{O}_{2}(g)$$\rightarrow\mbox{H}_{2}\mbox{SO}_{4}(l)\,\,\,\,\,\,\,\,\,\Delta H$$=-235,5\mbox{ kJ}$
$\mbox{SO}_{3}(g)+\mbox{H}_{2}\mbox{O}(l)$$\rightarrow\mbox{H}_{2}\mbox{S}(g)+2\mbox{O}_{2}(g)\Delta H$$=207,7\mbox{ kJ}$
$\underline{\mbox{H}_{2}\mbox{O}(g)\rightarrow\mbox{H}_{2}\mbox{O}(l)}$
$\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\Delta H=-44\mbox{ kJ}$$\mbox{SO}_{3}(g)+\mbox{H}_{2}\mbox{O}(g)$$\rightarrow\mbox{H}_{2}\mbox{SO}_{4}(l)$$\,\,\,\,\,\,\,\,\,\Delta H=-71,8\mbox{ kJ}$
-
Pertanyaan ke 5 dari 5
5. Pertanyaan
Bila seorang siswa menggunakan data-data berikut untuk menghitung reaksi disosiasi asam sulfat menjadi sulfur trioksida dan air, berapakah nilai yang ia dapat?
$\begin{array}{ccc}
\mbox{H}_{2}\mbox{S}(g) & + & 2\mbox{O}_{2}(g)\\
\mbox{H}_{2}\mbox{S}(g) & + & 2\mbox{O}_{2}(g)\\
\mbox{H}_{2}\mbox{O}(l)
\end{array}$$\begin{array}{cc}
\rightarrow & \mbox{H}_{2}\mbox{SO}_{4}(l)\\
\rightarrow & \mbox{SO}_{3}(g)\\
\rightarrow & \mbox{H}_{2}\mbox{O}(g)
\end{array}$$\begin{array}{cc}
\\
+ & \mbox{H}_{2}\mbox{O}(l)\\
\\
\end{array}$$\begin{array}{ccc}
\Delta H & = & -235,5\mbox{ kJ}\\
\Delta H & = & -207\mbox{ kJ}\\
\Delta H & = & 44\mbox{ kJ}
\end{array}$BetulKita hanya menggunakan data reaksi pertama dan kedua, karena disosiasi terjadi membentuk air, bukan uap air. Maka sesuai hukum Hess:
$\mbox{H}_{2}\mbox{SO}_{4}(l)$$\rightarrow\mbox{H}_{2}\mbox{S}(g)+2\mbox{O}_{2}(g)$$\:\,\:\:\:\:\,\,\Delta H=235,5\mbox{ kJ}$
$\mbox{H}_{2}\mbox{S}(g)+2\mbox{O}_{2}(g)$$\rightarrow\mbox{SO}_{3}(g)+\mbox{H}_{2}\mbox{O}(l)\,\Delta H$$\underline{=-207,7\mbox{ kJ}}$
$\mbox{H}_{2}\mbox{SO}_{4}(l)$$\rightarrow\mbox{SO}_{3}(g)+\mbox{H}_{2}\mbox{O}(l)$$\,\,\,\,\,\,\,\,\,\,\,\Delta H=27,8\mbox{ kJ}$
SalahKita hanya menggunakan data reaksi pertama dan kedua, karena disosiasi terjadi membentuk air, bukan uap air. Maka sesuai hukum Hess:
$\mbox{H}_{2}\mbox{SO}_{4}(l)$$\rightarrow\mbox{H}_{2}\mbox{S}(g)+2\mbox{O}_{2}(g)$$\:\,\:\:\:\:\,\,\Delta H=235,5\mbox{ kJ}$
$\mbox{H}_{2}\mbox{S}(g)+2\mbox{O}_{2}(g)$$\rightarrow\mbox{SO}_{3}(g)+\mbox{H}_{2}\mbox{O}(l)\,\Delta H$$\underline{=-207,7\mbox{ kJ}}$
$\mbox{H}_{2}\mbox{SO}_{4}(l)$$\rightarrow\mbox{SO}_{3}(g)+\mbox{H}_{2}\mbox{O}(l)$$\,\,\,\,\,\,\,\,\,\,\,\Delta H=27,8\mbox{ kJ}$
Latihan Soal Hukum Hess (Sukar)
Ringkasan kuis
0 dari 5 pertanyaan telah diselesaikan
Pertanyaan:
- 1
- 2
- 3
- 4
- 5
Informasi
You have already completed the quiz before. Hence you can not start it again.
Quiz is loading...
Anda harus masuk atau mendaftar untuk memulai kuis.
Anda harus menyelesaikan kuis dibawah ini, untuk memulai kuis ini:
Hasil
Hasil
0 dari 5 pertanyaan terjawab dengan benar
Waktu yang telah berlalu
Kategori
- Tidak Berkategori 0%
- 1
- 2
- 3
- 4
- 5
- Terjawab
- Tinjau
-
Pertanyaan ke 1 dari 5
1. Pertanyaan
Diketahui penguraian oksida dari besi sebagai berikut:
Penguraian 3,6 gram besi (II) oksida dibutuhkan energi 13,6 kJ.
Penguraian 4 gram besi (III) oksida dibutuhkan energi 20,605 kJ.
Pembentukan 9,28 gram $\mbox{Fe}_{3}\mbox{O}_{4}$ dilepaskan energi 44,736 kJ.
Berdasarkan data di atas berapakah $\Delta H$ reaksi dari $\mbox{Fe}_{3}\mbox{O}_{4}(s)$$\rightarrow\mbox{FeO}(s)$$+\mbox{Fe}_{2}\mbox{O}_{3}(s)$ adalah … . ($A_{r}$ Fe = 56; O = 16)
Betul{*} Penguraian 3,6 gram besi (II) oksida dibutuhkan energi 13,6 kJ
$\begin{alignedat}{1}n\mbox{ FeO} & =\frac{3,6}{(56+16)}\mbox{mol}\\
& =0,05\mbox{ mol}\\
\Delta H_{\mbox{D}}^{\circ} & =\frac{13,6\mbox{ kJ}}{0,05\mbox{ mol}}\\
& =272\mbox{ kJ/mol}
\end{alignedat}
$$\mbox{FeO}(s)$$\rightarrow\mbox{Fe}(s)+\frac{1}{2}\mbox{O}_{2}(g)\,\Delta H_{\mbox{D}}^{\circ}$
$=272$ kJ/mol{*} Penguraian 4 gram besi (III) oksida dibutuhkan energi 20,605 kJ.
$\begin{alignedat}{1}n\mbox{ Fe}_{2}\mbox{O}_{3} & =\frac{4}{((56\times2)+(16\times3))}\mbox{ mol}\\
& =0,025\mbox{ mol}\\
\Delta H_{D}^{\circ} & =\frac{20,605\mbox{ kJ}}{0,025\mbox{ mol}}\\
& =824,2\mbox{ kJ/mol}
\end{alignedat}
$$\mbox{Fe}_{2}\mbox{O}_{3}(s)$$\rightarrow2\mbox{Fe}(s)+\frac{3}{2}\mbox{O}_{2}(g)\Delta H_{\mbox{D}}^{\circ}$
$=824,2$ kJ/mol{*} Pembentukan 9,28 gram $\mbox{Fe}_{3}\mbox{O}_{4}$ dilepaskan energi 44,736 kJ.
$\begin{alignedat}{1}n\mbox{Fe}_{3}\mbox{O}_{4} & =\frac{9,28}{((56\times3)+(16\times4))}\mbox{ mol}\\
& =0,04\mbox{ mol}\\
\Delta H_{\mbox{f}}^{\circ} & =\frac{44,736\mbox{ kJ}}{0,04\mbox{ mol}}\\
& =1118,4\mbox{ kJ/mol}
\end{alignedat}
$$3\mbox{Fe}(s)+2\mbox{O}_{2}(g)\rightarrow\mbox{Fe}_{3}\mbox{O}_{4}(s)$$\Delta H_{\mbox{f}}^{\circ}=1118,4\mbox{ kJ/mol}$
$\begin{array}{c}
\mbox{Fe}(s)+\frac{1}{2}\mbox{O}_{2}(g)\rightarrow\mbox{FeO}(s)\,\,\,\,\,\,\,\Delta H=272\mbox{ kJ/mol}\,\,\,\,\\
2\mbox{Fe}(s)+\frac{3}{2}\mbox{O}_{2}(g)\rightarrow\mbox{Fe}_{2}\mbox{O}_{3}(s)\,\,\Delta H=824,2\mbox{ kJ/mol}\,\,\,\\
\underline{\mbox{Fe}_{3}\mbox{O}_{4}(s)\rightarrow3\mbox{Fe}(s)+2\mbox{O}_{2}(g)\,\,\Delta H=-1118,4\mbox{ kJ/mol}}\\
\mbox{Fe}_{3}\mbox{O}_{4}(s)\rightarrow\mbox{FeO}(s)+\mbox{Fe}_{2}\mbox{O}_{3}(s)\,\,\,\,\Delta H=-22,2\mbox{ kJ}
\end{array}$Salah{*} Penguraian 3,6 gram besi (II) oksida dibutuhkan energi 13,6 kJ
$\begin{alignedat}{1}n\mbox{ FeO} & =\frac{3,6}{(56+16)}\mbox{mol}\\
& =0,05\mbox{ mol}\\
\Delta H_{\mbox{D}}^{\circ} & =\frac{13,6\mbox{ kJ}}{0,05\mbox{ mol}}\\
& =272\mbox{ kJ/mol}
\end{alignedat}
$$\mbox{FeO}(s)$$\rightarrow\mbox{Fe}(s)+\frac{1}{2}\mbox{O}_{2}(g)\,\Delta H_{\mbox{D}}^{\circ}$
$=272$ kJ/mol{*} Penguraian 4 gram besi (III) oksida dibutuhkan energi 20,605 kJ.
$\begin{alignedat}{1}n\mbox{ Fe}_{2}\mbox{O}_{3} & =\frac{4}{((56\times2)+(16\times3))}\mbox{ mol}\\
& =0,025\mbox{ mol}\\
\Delta H_{D}^{\circ} & =\frac{20,605\mbox{ kJ}}{0,025\mbox{ mol}}\\
& =824,2\mbox{ kJ/mol}
\end{alignedat}
$$\mbox{Fe}_{2}\mbox{O}_{3}(s)$$\rightarrow2\mbox{Fe}(s)+\frac{3}{2}\mbox{O}_{2}(g)\Delta H_{\mbox{D}}^{\circ}$
$=824,2$ kJ/mol{*} Pembentukan 9,28 gram $\mbox{Fe}_{3}\mbox{O}_{4}$ dilepaskan energi 44,736 kJ.
$\begin{alignedat}{1}n\mbox{Fe}_{3}\mbox{O}_{4} & =\frac{9,28}{((56\times3)+(16\times4))}\mbox{ mol}\\
& =0,04\mbox{ mol}\\
\Delta H_{\mbox{f}}^{\circ} & =\frac{44,736\mbox{ kJ}}{0,04\mbox{ mol}}\\
& =1118,4\mbox{ kJ/mol}
\end{alignedat}
$$3\mbox{Fe}(s)+2\mbox{O}_{2}(g)\rightarrow\mbox{Fe}_{3}\mbox{O}_{4}(s)$$\Delta H_{\mbox{f}}^{\circ}=1118,4\mbox{ kJ/mol}$
$\begin{array}{c}
\mbox{Fe}(s)+\frac{1}{2}\mbox{O}_{2}(g)\rightarrow\mbox{FeO}(s)\,\,\,\,\,\,\,\Delta H=272\mbox{ kJ/mol}\,\,\,\,\\
2\mbox{Fe}(s)+\frac{3}{2}\mbox{O}_{2}(g)\rightarrow\mbox{Fe}_{2}\mbox{O}_{3}(s)\,\,\Delta H=824,2\mbox{ kJ/mol}\,\,\,\\
\underline{\mbox{Fe}_{3}\mbox{O}_{4}(s)\rightarrow3\mbox{Fe}(s)+2\mbox{O}_{2}(g)\,\,\Delta H=-1118,4\mbox{ kJ/mol}}\\
\mbox{Fe}_{3}\mbox{O}_{4}(s)\rightarrow\mbox{FeO}(s)+\mbox{Fe}_{2}\mbox{O}_{3}(s)\,\,\,\,\Delta H=-22,2\mbox{ kJ}
\end{array}$ -
Pertanyaan ke 2 dari 5
2. Pertanyaan
Dari data berikut:
Penguraian 3,6 gram besi (II) oksida dibutuhkan energi 13,6 kJ.
Penguraian 4 gram besi (III) oksida dibutuhkan energi 20,605 kJ.
Pembentukan 9,28 gram $\mbox{Fe}_{3}\mbox{O}_{4}$ dilepaskan energi 44,736 kJ.
Seorang ilmuwan merancang suatu percobaan pembentukan $\mbox{Fe}_{3}\mbox{O}_{4}$ dari $\mbox{FeO}$ dan sejumlah oksigen. Apabila ia menggunakan kalor sebesar 50000 J, berapakah massa $\mbox{Fe}_{3}\mbox{O}_{4}$ yang dapat terbentuk?
Betul$\mbox{FeO}(s)$$\rightarrow\mbox{Fe}(s)+\frac{1}{2}\mbox{O}_{2}(g)\,\Delta H_{\mbox{D}}^{\circ}$
$=272$ kJ/mol$\mbox{Fe}_{2}\mbox{O}_{3}(s)$$\rightarrow2\mbox{Fe}(s)+\frac{3}{2}\mbox{O}_{2}(g)\Delta H_{\mbox{D}}^{\circ}$
$=824,2$ kJ/mol$3\mbox{Fe}(s)+2\mbox{O}_{2}(g)\rightarrow\mbox{Fe}_{3}\mbox{O}_{4}(s)$$\Delta H_{\mbox{f}}^{\circ}=1118,4\mbox{ kJ/mol}$
Dari data yang ada, kita gunakan reaksi pertama dan ketiga:
$\mbox{FeO}(s)$$\rightarrow\mbox{Fe}(s)+\frac{1}{2}\mbox{O}_{2}(g)\,\Delta H$$=-272\mbox{ kJ/mol}$
$3\mbox{Fe}(s)+2\mbox{O}_{2}(g)$$\rightarrow\mbox{Fe}_{3}\mbox{O}_{4}(s)\,\Delta H$$=1118,4\mbox{ kJ/mol}$
Maka sesuai hukum Hess, kita perlu mengalikan 3 untuk reaksi pertama agar reaksi dapat berlangsung setara:
$3\mbox{FeO}(s)\rightarrow3\mbox{Fe}(s)+\frac{3}{2}\mbox{O}_{2}(g)\,\,\,\,\,\Delta H=-816\mbox{ kJ/mol}$
$\underline{3\mbox{Fe}(s)+2\mbox{O}_{2}(g)\rightarrow\mbox{Fe}_{3}\mbox{O}_{4}(s)\,\,\,\,\,\Delta H=1118,4\mbox{ kJ/mol}}$
$3\mbox{FeO}(s)+\frac{1}{2}\mbox{O}_{2}(g)\rightarrow\mbox{Fe}_{3}\mbox{O}_{4}(s)\,\,\,\,\Delta H=302,4\mbox{ kJ/mol}$
Sehingga jumlah $Fe_{3}O_{4}$yang didapat dengan memberikan 50000 J adalah;
$=\frac{50000}{302400}\times232\mbox{ g}=38,36$ gram.
Salah$\mbox{FeO}(s)$$\rightarrow\mbox{Fe}(s)+\frac{1}{2}\mbox{O}_{2}(g)\,\Delta H_{\mbox{D}}^{\circ}$
$=272$ kJ/mol$\mbox{Fe}_{2}\mbox{O}_{3}(s)$$\rightarrow2\mbox{Fe}(s)+\frac{3}{2}\mbox{O}_{2}(g)\Delta H_{\mbox{D}}^{\circ}$
$=824,2$ kJ/mol$3\mbox{Fe}(s)+2\mbox{O}_{2}(g)\rightarrow\mbox{Fe}_{3}\mbox{O}_{4}(s)$$\Delta H_{\mbox{f}}^{\circ}=1118,4\mbox{ kJ/mol}$
Dari data yang ada, kita gunakan reaksi pertama dan ketiga:
$\mbox{FeO}(s)$$\rightarrow\mbox{Fe}(s)+\frac{1}{2}\mbox{O}_{2}(g)\,\Delta H$$=-272\mbox{ kJ/mol}$
$3\mbox{Fe}(s)+2\mbox{O}_{2}(g)$$\rightarrow\mbox{Fe}_{3}\mbox{O}_{4}(s)\,\Delta H$$=1118,4\mbox{ kJ/mol}$
Maka sesuai hukum Hess, kita perlu mengalikan 3 untuk reaksi pertama agar reaksi dapat berlangsung setara:
$3\mbox{FeO}(s)\rightarrow3\mbox{Fe}(s)+\frac{3}{2}\mbox{O}_{2}(g)\,\,\,\,\,\Delta H=-816\mbox{ kJ/mol}$
$\underline{3\mbox{Fe}(s)+2\mbox{O}_{2}(g)\rightarrow\mbox{Fe}_{3}\mbox{O}_{4}(s)\,\,\,\,\,\Delta H=1118,4\mbox{ kJ/mol}}$
$3\mbox{FeO}(s)+\frac{1}{2}\mbox{O}_{2}(g)\rightarrow\mbox{Fe}_{3}\mbox{O}_{4}(s)\,\,\,\,\Delta H=302,4\mbox{ kJ/mol}$
Sehingga jumlah $Fe_{3}O_{4}$yang didapat dengan memberikan 50000 J adalah;
$=\frac{50000}{302400}\times232\mbox{ g}=38,36$ gram.
-
Pertanyaan ke 3 dari 5
3. Pertanyaan
Diketahui persamaan termokimia berikut:
$2\mbox{N}_{2}(g)$$+6\mbox{O}_{2}(g)$$+2\mbox{H}_{2}(g)$$\rightarrow4\mbox{HNO}_{3}(\ell)\,\Delta H$$=-696,4$ kJ
$\mbox{N}_{2}(g)+\frac{5}{2}\mbox{O}_{2}(g)$$\rightarrow\mbox{N}_{2}\mbox{O}_{5}(g)\,\Delta H$$=-11,3$ kJ
$\mbox{N}_{2}\mbox{O}_{5}(g)+\mbox{H}_{2}\mbox{O}(\ell)$$\rightarrow2\mbox{HNO}_{3}(\ell)\,\Delta H$$=-73,7$ kJ
Tentukan $\Delta H$ untuk pembakaran 3 gram gas hidrogen pada kondisi RTP.
Betul$\begin{array}{c}
\mbox{H}_{2}\mbox{O}(\ell)\rightarrow\mbox{H}_{2}(g)+\frac{1}{2}\mbox{O}_{2}(g)\hspace{1em}\Delta H=x\mbox{ kJ}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}(\times2)\\
2\mbox{N}_{2}(g)+6\mbox{O}_{2}(g)+2\mbox{H}_{2}(g)\rightarrow4\mbox{HNO}_{3}(\ell)\,\,\Delta H=-696,4\mbox{ kJ}\,\,\,\\
\underline{\mbox{N}_{2}(g)+\frac{5}{2}\mbox{O}_{2}(g)\rightarrow\mbox{N}_{2}\mbox{O}_{5}(g)\hspace{1em}\Delta H=-11,3\mbox{ kJ}}\hspace{1em}\hspace{1em}(\times2)\\
\mbox{N}_{2}\mbox{O}_{5}(g)+\mbox{H}_{2},O(\ell)\rightarrow2\mbox{HNO}_{3}(\ell)\hspace{1em}\Delta H=-73,7\mbox{ kJ}\hspace{1em}(\times2)
\end{array}$sehingga menjadi,
$\begin{array}{c}
2\mbox{H}_{2}\mbox{O}(\ell)\rightarrow2\mbox{H}_{2}(g)+\mbox{O}_{2}(g)\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\Delta H=2x\mbox{ kJ}\\
2\mbox{N}_{2}(g)+6\mbox{O}_{2}(g)+2\mbox{H}_{2}(g)\rightarrow4\mbox{HNO}_{3}(\ell)\hspace{1em}\Delta H=-696,4\mbox{ kJ}\\
\underline{2\mbox{N}_{2}(g)+5\mbox{O}_{2}(g)\rightarrow2\mbox{N}_{2}\mbox{O}_{5}(g)\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\Delta H=-22,6\mbox{ kJ}}\\
2\mbox{N}_{2}\mbox{O}_{5}(g)+2\mbox{H}_{2}\mbox{O}(\ell)\rightarrow4\mbox{HNO}_{3}(\ell)\hspace{1em}\hspace{1em}\Delta H=-147,4\mbox{ kJ}
\end{array}$$\begin{alignedat}{1}-147,4\mbox{ kJ} & =2x+(-696,4\mbox{ kJ})+(-22,6\mbox{ kJ})\\
-147,4\mbox{ kJ} & =2x+(-719\mbox{ kJ})\\
2x & =571,6\mbox{ kJ}\\
x & =285,8\mbox{ kJ}
\end{alignedat}
$Sehingga diperoleh pembentukan 1 mol $\mbox{H}_{2}\mbox{O}(\ell)$
$\mbox{H}_{2}(g)+\frac{1}{2}\mbox{O}_{2}(g)\rightarrow\mbox{H}_{2}\mbox{O}(\ell)\,\,\Delta H=-285,8\mbox{ kJ}$
$\Delta H$ untuk pembakaran gas hidrogen (RTP) sama dengan pembentukan $\mbox{H}_{2}\mbox{O}(\ell)$, sehingga $\Delta H$ pembakaran 3 gram gas hidrogen:
$\begin{alignedat}{1}n\mbox{ H}_{2} & =\frac{3}{2}\mbox{ mol}\\
& =1,5\mbox{ mol}\\
\Delta H & =1,5\times(-285,8)\mbox{ kJ}\\
& =-428,7\mbox{ kJ}.
\end{alignedat}
$Salah$\begin{array}{c}
\mbox{H}_{2}\mbox{O}(\ell)\rightarrow\mbox{H}_{2}(g)+\frac{1}{2}\mbox{O}_{2}(g)\hspace{1em}\Delta H=x\mbox{ kJ}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}(\times2)\\
2\mbox{N}_{2}(g)+6\mbox{O}_{2}(g)+2\mbox{H}_{2}(g)\rightarrow4\mbox{HNO}_{3}(\ell)\,\,\Delta H=-696,4\mbox{ kJ}\,\,\,\\
\underline{\mbox{N}_{2}(g)+\frac{5}{2}\mbox{O}_{2}(g)\rightarrow\mbox{N}_{2}\mbox{O}_{5}(g)\hspace{1em}\Delta H=-11,3\mbox{ kJ}}\hspace{1em}\hspace{1em}(\times2)\\
\mbox{N}_{2}\mbox{O}_{5}(g)+\mbox{H}_{2},O(\ell)\rightarrow2\mbox{HNO}_{3}(\ell)\hspace{1em}\Delta H=-73,7\mbox{ kJ}\hspace{1em}(\times2)
\end{array}$sehingga menjadi,
$\begin{array}{c}
2\mbox{H}_{2}\mbox{O}(\ell)\rightarrow2\mbox{H}_{2}(g)+\mbox{O}_{2}(g)\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\Delta H=2x\mbox{ kJ}\\
2\mbox{N}_{2}(g)+6\mbox{O}_{2}(g)+2\mbox{H}_{2}(g)\rightarrow4\mbox{HNO}_{3}(\ell)\hspace{1em}\Delta H=-696,4\mbox{ kJ}\\
\underline{2\mbox{N}_{2}(g)+5\mbox{O}_{2}(g)\rightarrow2\mbox{N}_{2}\mbox{O}_{5}(g)\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\Delta H=-22,6\mbox{ kJ}}\\
2\mbox{N}_{2}\mbox{O}_{5}(g)+2\mbox{H}_{2}\mbox{O}(\ell)\rightarrow4\mbox{HNO}_{3}(\ell)\hspace{1em}\hspace{1em}\Delta H=-147,4\mbox{ kJ}
\end{array}$$\begin{alignedat}{1}-147,4\mbox{ kJ} & =2x+(-696,4\mbox{ kJ})+(-22,6\mbox{ kJ})\\
-147,4\mbox{ kJ} & =2x+(-719\mbox{ kJ})\\
2x & =571,6\mbox{ kJ}\\
x & =285,8\mbox{ kJ}
\end{alignedat}
$Sehingga diperoleh pembentukan 1 mol $\mbox{H}_{2}\mbox{O}(\ell)$
$\mbox{H}_{2}(g)+\frac{1}{2}\mbox{O}_{2}(g)\rightarrow\mbox{H}_{2}\mbox{O}(\ell)\,\,\Delta H=-285,8\mbox{ kJ}$
$\Delta H$ untuk pembakaran gas hidrogen (RTP) sama dengan pembentukan $\mbox{H}_{2}\mbox{O}(\ell)$, sehingga $\Delta H$ pembakaran 3 gram gas hidrogen:
$\begin{alignedat}{1}n\mbox{ H}_{2} & =\frac{3}{2}\mbox{ mol}\\
& =1,5\mbox{ mol}\\
\Delta H & =1,5\times(-285,8)\mbox{ kJ}\\
& =-428,7\mbox{ kJ}.
\end{alignedat}
$ -
Pertanyaan ke 4 dari 5
4. Pertanyaan
Hitunglah perubahan standar entalpi pembakaran etanatiol dengan menggunakan data berikut (pembakaran sempurna senyawa tiol menghasilkan sulfur dioksida)!
$\Delta H_{\mbox{C}}^{\circ}\mbox{C}(s)$$=-394$ kJ/mol
$\Delta H_{\mbox{C}}^{\circ}\mbox{H}_{2}(g)$ $=-286$ kJ/mol
$\Delta H_{\mbox{C}}^{\circ}\mbox{S}(s)$$=-297$ kJ/mol
$\Delta H_{\mbox{f}}^{\circ}\mbox{C}_{2}\mbox{H}_{5}\mbox{SH}(\ell)$$=-774$ kJ/mol
Betul$\begin{array}{c}
\mbox{C}(s)+\mbox{O}_{2}(g)\rightarrow\mbox{CO}_{2}(g)\hspace{1em}\Delta H_{\mbox{C}}^{\circ}=-394\mbox{ kJ/mol}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}(\times2)\\
\mbox{H}_{2}(g)+\frac{1}{2}\mbox{O}_{2}(g)\rightarrow\mbox{H}_{2}\mbox{O}(\ell)\hspace{1em}\Delta H_{\mbox{C}}^{\circ}=-286\mbox{ kJ/mol}\hspace{1em}\hspace{1em}(\times3)\\
\mbox{S}(s)+\mbox{O}_{2}(g)\rightarrow\mbox{SO}_{2}(g)\hspace{1em}\Delta H_{\mbox{C}}^{\circ}=-297\mbox{ kJ/mol}\hspace{1em}\hspace{1em}\hspace{1em}(\times1)\\
\underline{\mbox{C}_{2}\mbox{H}_{5}\mbox{SH}(\ell)\rightarrow2\mbox{C}(s)+3\mbox{H}_{2}(g)+\mbox{S}(s)\hspace{1em}\Delta H_{\mbox{f}}^{\circ}=+774\mbox{ kJ/mol}}\hspace{1em}(\times1)\\
\mbox{C}_{2}\mbox{H}_{5}\mbox{SH}(\ell)+\frac{9}{2}\mbox{O}_{2}(g)\rightarrow2\mbox{CO}_{2}(g)+3\mbox{H}_{2}\mbox{O}(\ell)+\mbox{SO}_{2}(g)\Delta H=-1169\hspace{1em}\mbox{kJ/mol}
\end{array}$Salah$\begin{array}{c}
\mbox{C}(s)+\mbox{O}_{2}(g)\rightarrow\mbox{CO}_{2}(g)\hspace{1em}\Delta H_{\mbox{C}}^{\circ}=-394\mbox{ kJ/mol}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}(\times2)\\
\mbox{H}_{2}(g)+\frac{1}{2}\mbox{O}_{2}(g)\rightarrow\mbox{H}_{2}\mbox{O}(\ell)\hspace{1em}\Delta H_{\mbox{C}}^{\circ}=-286\mbox{ kJ/mol}\hspace{1em}\hspace{1em}(\times3)\\
\mbox{S}(s)+\mbox{O}_{2}(g)\rightarrow\mbox{SO}_{2}(g)\hspace{1em}\Delta H_{\mbox{C}}^{\circ}=-297\mbox{ kJ/mol}\hspace{1em}\hspace{1em}\hspace{1em}(\times1)\\
\underline{\mbox{C}_{2}\mbox{H}_{5}\mbox{SH}(\ell)\rightarrow2\mbox{C}(s)+3\mbox{H}_{2}(g)+\mbox{S}(s)\hspace{1em}\Delta H_{\mbox{f}}^{\circ}=+774\mbox{ kJ/mol}}\hspace{1em}(\times1)\\
\mbox{C}_{2}\mbox{H}_{5}\mbox{SH}(\ell)+\frac{9}{2}\mbox{O}_{2}(g)\rightarrow2\mbox{CO}_{2}(g)+3\mbox{H}_{2}\mbox{O}(\ell)+\mbox{SO}_{2}(g)\Delta H=-1169\hspace{1em}\mbox{kJ/mol}
\end{array}$ -
Pertanyaan ke 5 dari 5
5. Pertanyaan
Berikut ini diketahui beberapa entalpi molar senyawa:
$\frac{1}{2}\mbox{N}_{2}(g)+\mbox{O}_{2}(g)$$\rightarrow\mbox{NO}_{2}(g)\Delta H_{\mbox{f}}^{\circ}$
$=+34$ kJ/mol$\mbox{C}(s)+\mbox{O}_{2}(g)$ $\rightarrow\mbox{CO}_{2}(g)\Delta H_{\mbox{f}}^{\circ}$$=-394$ kJ/mol
$\mbox{H}_{2}(g)+\frac{1}{2}\mbox{O}_{2}(g)$ $\rightarrow\mbox{H}_{2}\mbox{O}(g)\Delta H_{\mbox{f}}^{\circ}$$=-242$ kJ/mol
$3\mbox{C}(s)+\frac{5}{2}\mbox{H}_{2}(g)$$+\frac{3}{2}\mbox{N}_{2}(g)+\frac{9}{2}\mbox{O}_{2}(g)$$\rightarrow\mbox{C}_{3}\mbox{H}_{5}\mbox{N}_{3}\mbox{O}_{9}(\ell)\Delta H_{\mbox{f}}^{\circ}$$=-145$ kJ/mol
Berdasarkan data di atas, tentukan perubahan entalpi pembakaran sempurna nitrogliserin $\left(\mbox{C}_{3}\mbox{H}_{5}\mbox{N}_{3}\mbox{O}_{9}\right)$ bila diketahui bahwa terbentuk pula nitrogen dioksida!
Betul$\begin{array}{c}
\frac{1}{2}\mbox{N}_{2}(g)+\mbox{O}_{2}(g)\rightarrow\mbox{NO}_{2}(g)\hspace{1em}\Delta H_{\mbox{f}}^{\circ}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}=+34\mbox{ kJ/mol}\hspace{1em}(\times3)\\
\mbox{C}(s)+\mbox{O}_{2}(g)\rightarrow\mbox{CO}_{2}(g)\hspace{1em}\Delta H_{\mbox{f}}^{\circ}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}=-394\mbox{ kJ/mol}\hspace{1em}(\times3)\\
\mbox{H}_{2}(g)+\frac{1}{2}\mbox{O}_{2}(g)\rightarrow\mbox{H}_{2}\mbox{O}(g)\Delta H_{\mbox{f}}^{\circ}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}=-242\mbox{ kJ/mol}\hspace{1em}(\times\frac{5}{2})\\
\mbox{C}_{3}\mbox{H}_{5}\mbox{N}_{3}\mbox{O}_{9}\underline{(\ell)\rightarrow3\mbox{C}(s)+\frac{5}{2}\mbox{H}_{2}(g)+\frac{3}{2}\mbox{N}_{2}(g)+\frac{9}{2}\mbox{O}_{2}(g)\hspace{1em}\Delta H_{\mbox{f}}^{\circ}={\color{red}+}145\mbox{ kJ/mol}\hspace{1em}(\times1)}\\
\mbox{C}_{3}\mbox{H}_{5}\mbox{N}_{3}\mbox{O}_{9}(\ell)+\frac{11}{4}\mbox{O}_{2}(g)\rightarrow3\mbox{CO}_{2}(g)+\frac{5}{2}\mbox{H}_{2}\mbox{O}(g)+3\mbox{NO}_{2}(g)\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}-1540\mbox{ kJ/mol}
\end{array}$Salah$\begin{array}{c}
\frac{1}{2}\mbox{N}_{2}(g)+\mbox{O}_{2}(g)\rightarrow\mbox{NO}_{2}(g)\hspace{1em}\Delta H_{\mbox{f}}^{\circ}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}=+34\mbox{ kJ/mol}\hspace{1em}(\times3)\\
\mbox{C}(s)+\mbox{O}_{2}(g)\rightarrow\mbox{CO}_{2}(g)\hspace{1em}\Delta H_{\mbox{f}}^{\circ}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}=-394\mbox{ kJ/mol}\hspace{1em}(\times3)\\
\mbox{H}_{2}(g)+\frac{1}{2}\mbox{O}_{2}(g)\rightarrow\mbox{H}_{2}\mbox{O}(g)\Delta H_{\mbox{f}}^{\circ}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}=-242\mbox{ kJ/mol}\hspace{1em}(\times\frac{5}{2})\\
\mbox{C}_{3}\mbox{H}_{5}\mbox{N}_{3}\mbox{O}_{9}\underline{(\ell)\rightarrow3\mbox{C}(s)+\frac{5}{2}\mbox{H}_{2}(g)+\frac{3}{2}\mbox{N}_{2}(g)+\frac{9}{2}\mbox{O}_{2}(g)\hspace{1em}\Delta H_{\mbox{f}}^{\circ}={\color{red}+}145\mbox{ kJ/mol}\hspace{1em}(\times1)}\\
\mbox{C}_{3}\mbox{H}_{5}\mbox{N}_{3}\mbox{O}_{9}(\ell)+\frac{11}{4}\mbox{O}_{2}(g)\rightarrow3\mbox{CO}_{2}(g)+\frac{5}{2}\mbox{H}_{2}\mbox{O}(g)+3\mbox{NO}_{2}(g)\hspace{1em}\hspace{1em}\hspace{1em}\hspace{1em}-1540\mbox{ kJ/mol}
\end{array}$




